بين حمض الكربوكسيلية واستر
حمض الكربوكسيلية مقابل استر
الأحماض الكربوكسيلية والاسترات هي جزيئات عضوية مع المجموعة -COO. ويرتبط ذرة الأوكسجين واحد إلى الكربون مع رابطة مزدوجة، والأوكسجين الآخر هو المستعبدين مع رابطة واحدة. منذ ثلاث ذرات فقط ترتبط ذرة الكربون، ولها هندسة مستو ثلاثي الأضلاع حوله. وعلاوة على ذلك، ذرة الكربون سب 2 هجين. مجموعة الكربوكسيل هي مجموعة وظيفية تحدث على نطاق واسع في الكيمياء والكيمياء الحيوية. هذه المجموعة هي والدة الأسرة ذات الصلة من المركبات المعروفة باسم مركبات أسيل. وتعرف مركبات أسيل أيضا بمشتقات حمض الكربوكسيلية. استر هو مشتق حمض الكربوكسيلية من هذا القبيل.
حمض الكربوكسيلية
الأحماض الكربوكسيلية هي المركبات العضوية التي لها مجموعة وظيفية -COOH. تعرف هذه المجموعة باسم مجموعة الكربوكسيل. حمض الكربوكسيلية له صيغة عامة على النحو التالي.
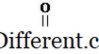
في أبسط نوع من حمض الكربوكسيلية، يساوي R مجموعة H. يعرف هذا الحمض الكربوكسيلية كحامض الفورميك. على الرغم من حمض الفورميك، وهناك العديد من أنواع أخرى من الأحماض الكربوكسيلية مع مجموعات R مختلفة. مجموعة R يمكن أن تكون سلسلة الكربون على التوالي، سلسلة متفرعة، مجموعة العطرية، الخ حامض الخليك وحمض هيكسانويك، وحمض البنزويك هي بعض الأمثلة للأحماض الكربوكسيلية. في تسمية إيوباك، يتم تسمية الأحماض الكربوكسيلية عن طريق إسقاط النهائي - e من اسم الألكان الموافق لأطول سلسلة في الحمض وبإضافة حمض أويك. دائما، يتم تعيين الكربون الكربوكسيل رقم 1. وفقا لهذا، اسم إيوباك لحمض الخليك هو حمض الإيثانويك. بخلاف أسماء إيوباك، فإن العديد من الأحماض الكربوكسيلية لها أسماء شائعة.
الأحماض الكربوكسيلية هي جزيئات قطبية. بسبب مجموعة -OH، فإنها يمكن أن تشكل روابط الهيدروجين قوية مع بعضها البعض، ومع الماء. ونتيجة لذلك، الأحماض الكربوكسيلية لديها نقاط الغليان عالية. وعلاوة على ذلك، الأحماض الكربوكسيلية مع الأوزان الجزيئية أقل تذوب بسهولة في الماء. ومع ذلك، كلما زاد طول سلسلة الكربون، تنخفض القابلية للذوبان. الأحماض الكربوكسيلية لديها حموضة تتراوح بين يكا 4-5. وبما أنها حمضية، فإنها تتفاعل بسهولة مع هيدروكسيد الصوديوم و ناهكو 3 حلول لتشكيل أملاح الصوديوم القابلة للذوبان. الأحماض الكربوكسيلية مثل حمض الأسيتيك هي الأحماض الضعيفة، وهي موجودة في التوازن مع قاعدتها المترافقة في الوسط المائي. ومع ذلك، إذا كانت الأحماض الكربوكسيلية لديها مجموعات سحب الإلكترون مثل كل، F، فهي حمضية من حمض غير مستبد.
استر
استير لديها صيغة عامة من ركور '. يرصد الاسترات عن طريق التفاعل بين حمض الكربوكسيلية مع الكحول. يدعى استيرس عن طريق كتابة أسماء جزء الكحول المستمدة أولا. ثم يتم كتابة الاسم المستمد من الجزء الحمضي مع نهاية - أكل أو - أويت.على سبيل المثال، أسيتات الإيثيل هو اسم استر التالية.

إسترات هي مركبات قطبية. ولكن ليس لديهم القدرة على تكوين روابط هيدروجينية قوية لبعضهم البعض بسبب نقص الهيدروجين المحصور بالأكسجين. ونتيجة لذلك، الاسترات ديك نقاط الغليان أقل بالمقارنة مع الأحماض أو الكحول مع الأوزان الجزيئية مماثلة. غالبا ما يكون الاسترات رائحة لطيفة، وهي المسؤولة عن إنتاج الروائح المميزة من الفواكه والزهور، وما إلى ذلك
|
ما هو الفرق بين حمض الكربوكسيلية واستر ؟ • استرات هي مشتقات حمض الكربوكسيلية. • تحتوي الأحماض الكربوكسيلية على صيغة عامة ل ركوه. استير لها صيغة عامة من ركور '. • الأحماض الكربوكسيلية يمكن أن تجعل روابط الهيدروجين قوية، ولكن استرات لا يمكن. • نقاط غليان الإسترات أقل من أحماض الكربوكسيلية. • بالمقارنة مع الأحماض منخفضة الوزن الجزيئي، غالبا ما يكون الاسترات رائحة لطيفة. |


