الفرق بين المعايرة الحمضية القاعدية ومعايرة الأكسدة | حمض المعايرة المعايرة المعاكس الأكسدة
الفرق الرئيسي - المعايرة الحمضية القاعدية مقابل المعايرة الأكسدة
وتستخدم المعايرة لتحديد تركيز محلول غير معروف (أنيليت). الأكثر شيوعا اثنين من أساليب تيتريمتريك هي الحمض القاعدي المعايرة ومعايرة الأكسدة. الفرق الرئيسي بين المعايرة الحمضية القاعدية ومعايرة الأكسدة هو طبيعة التفاعل الذي يحدث بين عيار المعايرة والحليلة في المعايرة. في المعايرة الحمضية القاعدية، رد فعل التعادل يحدث وفي المعايرة الأكسدة، رد فعل الأكسدة يحدث (رد فعل مؤكسد ورد فعل الحد من). استخدام المؤشرات هي الطريقة الأكثر شيوعا لتحديد نقطة النهاية للتفاعل.
ما هو معايرة حمض القاعدة؟
في المعايرة الحمضية القاعدية، يتم استخدام حمض (المعايرة الحمضية) أو قاعدة (المعايرة الأساسية) كما تميانت. أمثلة على الأحماض المستخدمة في المعايرة الحمضية هي 2 سو 4 ، هكل، أو هنو 3. <> <> 999 <3 أو 2 كو 3. ويمكن تصنيف المعايرة الحمضية القاعدة على النحو التالي اعتمادا على قوة من الحمض والقاعدة.
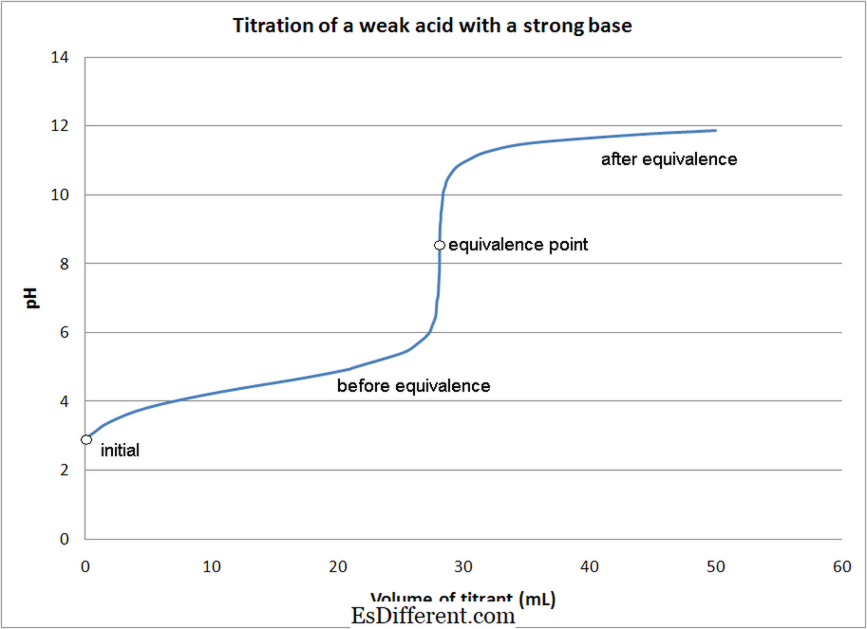
- حمض ضعيف - ضعف المعايرة قاعدة
- في معظم حمض المعايرة -Base، وتستخدم المؤشرات لتحديد نقطة نهاية رد الفعل. وتستخدم مؤشرات مختلفة اعتمادا على نوع المعايرة كما ذكر أعلاه.
- ما هو المعايرة الأكسدة؟
وتشمل المعايرة الأكسدة رد فعل الأكسدة. رد فعل الأكسدة رد فعل اثنين. تفاعل الأكسدة و رد فعل الحد. يتم كل من عمليات الأكسدة والحد من مكان في نفس الوقت حيث يسمح لنا لتحديد الانتهاء من رد فعل. ويعرف هذا أيضا باسم نقطة النهاية من المعايرة. ويمكن تحديد ذلك بعدة طرق؛ وذلك باستخدام أقطاب المؤشرات ومؤشرات الأكسدة (ينتج المؤشر لونا مختلفا في حالة الحد من الأكسدة)، ومؤشرات عدم الأكسدة (ينتج المؤشر لونا عند إضافة كمية زائدة من التماثلية).
طبيعة التفاعل:
المعايرة الحمضية القاعدية:

تشمل المعايرة الحمضية القاعدية تفاعل التعادل بين الحليلة (الحل مع التركيز المجهول) والعيار الحمضي أو الأساسي.
الأكسدة المعايرة:
رد فعل الأكسدة ينطوي على تفاعل الأكسدة والحد من بين الحليلة والمعايرة. ليس هناك قاعدة من هذا القبيل يتأكسد المكون وأي واحد يقلل. إما أن تحلل أو تماثل المعايرة، ويقلل المكون المتبقي وفقا لذلك. تحديد نقطة النهاية:
المعايرة الحمضية القاعدية: بشكل عام، يتم استخدام مؤشر الرقم الهيدروجيني، عداد ف أو مقياس تصرف لتحديد نقطة النهاية من المعايرة الحمضية القاعدية.
الأكسدة المعايرة:
الطرق الأكثر شيوعا لتحديد نقطة نهاية رد فعل الأكسدة تستخدم مقياس الجهد أو مؤشر الأكسدة. ولكن، في معظم الأحيان إما الحليلة أو عابرة تنتج لون في نقطة النهاية. ومن ثم لا يلزم وضع مؤشرات إضافية في تلك الحالات. أمثلة:
المعايرة الحمضية قاعدة: - ديفيس المادة قبل منتصف الجدول ->
نوع
رد الفعل (المؤشر)
حمض قوي - معايرة قاعدة قوية| هكل + نوهاناكل + H | 2 |
| O (فينولفثالين / ميثيل برتقالي | حمض قوي - معايرة قاعدة ضعيفة حمض الهيدروكلوريك + نه 3 |
| à نه | 3 كل (ميثيل أورانج) حمض ضعيف - سترونغ بيس تيتراتيون < تش 3 كوه + NaOHà تش |
| 3 | كونا + H 2 O (فينولفثالين) كوه + نه 3 à |
| 3 | كو - + نه 4 + (لا يوجد مؤشرات مناسبة) ريدوكس المعايرة: 2 كمنو 4 + 5 H 2 C |
2
O 4 + 6 حمض الهيدروكلوريك < > 2 منكل 2 + 2KCl + 10 كو 2 + 8 H 2 O (+ 7) (+3) (+2) 4) في التفاعل أعلاه، يتم تقليل برمنجنات بينما يتأكسد حمض الأكساليك. عند اكتمال التفاعل، اللون الأرجواني من برمنغنات يتغير إلى عديم اللون. كمنو 4 + 5FeCl 2 + 8HCl →
5FeCl
3
+ منكل 2 + بوكل + 4H 2 O (+ 7) (+2) (+3) (+2) إيماج كورتيسي: 1. معايرة حمض ضعيف مع قاعدة قوية بواسطة كوانتومكينيتيكش (العمل الخاص) [سيسي بي 3. 0]، عبر ويكيميديا كومنز 2. "معايرة وينكلر المعايرة المسبقة" بواسطة ويلوود [سيسي بي-سا 3. 0] عبر العموم




