الفرق بين طومسون وروثرفورد نموذج أتوم | طومسون فس رثرفورد نموذج أتوم
الفرق الرئيسي - طومسون فس رثرفورد نموذج أتوم
الفرق الرئيسي بين طومسون وروثرفورد نموذج الذرة هو أن طومسون نموذج الذرة لا يحتوي على أي تفاصيل حول نواة في حين روثرفورد نموذج ذرة يفسر عن نواة الذرة. J. ج. طومسون كان أول من اكتشف الجسيمات دون الذرية التي تسمى الإلكترون في عام 1904. وكان النموذج الذي اقترحه يطلق عليه اسم "نموذج البودوم البودينغ من الذرة". ولكن في عام 1911، جاء إرنست رثرفورد مع نموذج جديد للذرة بعد اكتشافه للنواة الذرية في عام 1909.
المحتويات
1. نظرة عامة والفرق الرئيسي
2. ما هو نموذج طومسون أتوم
3. ما هو رثرفورد نموذج أتوم
4. جنبا إلى جنب مقارنة - طومسون فس رثرفورد نموذج أتوم في شكل جدولي
5. ملخص
ما هو نموذج طومسون أتوم؟
نموذج طومسون للذرة يسمى نموذج البرقوق لأنه ينص على أن الذرة تبدو مثل البرقوق. التفاصيل الوحيدة المعروفة عن الذرة في ذلك الوقت كانت
- <>>> <>>- الذرات تتكون من الإلكترونات
- الإلكترونات هي جسيمات مشحونة سلبا
- ذرات مشحونة
منذ إلكترونات مشحونة سلبا، اقترح طومسون أن يكون هناك شحنة موجبة من أجل تحييد الشحنة الكهربائية للذرة. ويوضح نموذج ذومسون للذرة أن الإلكترونات مدمجة في مادة صلبة مشحونة بشكل إيجابي وهي كروية الشكل. يبدو هذا الهيكل مثل الحلوى مع الخوخ جزءا لا يتجزأ من ذلك وكان اسمه كما البرقوق نموذج الحلوى من الذرة. وقد أثبت هذا الافتراض أن الدول ذرة محايدة بحماس لأن هذا النموذج ينص على أن الرسوم السلبية للإلكترونات تحيد بواسطة الشحنة الموجبة للمجال الصلب. على الرغم من أن هذا النموذج أثبت أن الذرات مشحونة محايدة، ورفض بعد اكتشاف النواة.

الشكل 01: نموذج طومسون أتوم
ما هو نموذج رثرفورد أتوم؟
وفقا لنموذج رثرفورد للذرة، كان ما يسمى نموذج البرقوق من طومسون غير صحيح. نموذج روثرفورد للذرة يسمى أيضا النموذج النووي لأنه يوفر تفاصيل حول نواة الذرة.
التجربة الشهيرة تسمى "روثرفورد الذهب احباط التجربة" أدى إلى اكتشاف النواة. في هذه التجربة، قصفت جسيمات ألفا من خلال رقائق الذهب؛ وكان من المتوقع أن تذهب مباشرة من خلال احباط الذهب. ولكن بدلا من الاختراق المباشر، تحولت جسيمات ألفا إلى اتجاهات مختلفة.
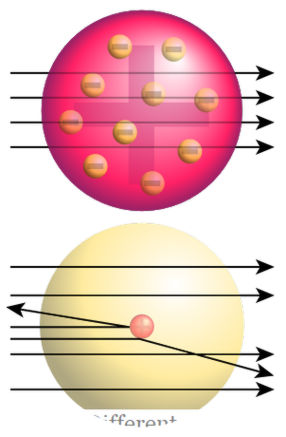
الشكل 02: تجربة روثرفورد الذهب احباط أعلى: النتائج المتوقعة (الاختراق على التوالي) أسفل : النتائج المرصودة (انحراف بعض الجسيمات)
وهذا يدل على أن هناك شيء الصلبة مع شحنة موجبة في تلك احباط الذهب الذي يسبب الاصطدام مع جسيمات ألفا. سميت روثرفورد هذه النواة الإيجابية باعتبارها النواة. ثم اقترح النموذج النووي للذرة. كان يتألف من نواة موجبة الشحنة والإلكترونات سالبة الشحنة المحيطة النواة. واقترح أيضا أن تكون الإلكترونات في المدارات حول النواة في مسافات معينة. ويسمى هذا النموذج أيضا نموذج الكواكب لأن روثرفورد اقترح أن الإلكترونات تقع حول النواة مماثلة للكواكب الواقعة حول الشمس.
وفقا لهذا النموذج،
- وتتكون الذرة من مركز شحنة موجبة والتي تسمى النواة. يحتوي هذا المركز على كتلة الذرة.
- وتقع الإلكترونات خارج النواة في المدارات على مسافة كبيرة.
- عدد الإلكترونات يساوي عدد التهم الإيجابية (تسمى لاحقا البروتونات) في النواة.
- حجم النواة لا يكاد يذكر عند مقارنتها بحجم الذرة. وبالتالي، فإن معظم المساحة في الذرة فارغة.
ومع ذلك، تم رفض هذا النموذج رثرفورد من الذرة أيضا لأنه لا يمكن تفسير لماذا لا تجذب الإلكترونات والرسوم الإيجابية في النواة لبعضها البعض.

الشكل 03: رثرفورد نموذج أتوم
ما هو الفرق بين طومسون و رثرفورد نموذج أتوم؟
- ديف المادة قبل منتصف الجدول>>
طومسون فس رثرفورد نموذج أتوم |
|
| طومسون نموذج الذرة هو النموذج الذي ينص على أن الإلكترونات هي جزءا لا يتجزأ من مادة صلبة مشحونة إيجابيا التي هي كروية في الشكل. | نموذج رثرفورد للذرة هو النموذج الذي يفسر أن هناك نواة في وسط الذرة والإلكترونات تقع حول النواة. |
| نواة | |
| نموذج طومسون للذرة لا يعطي أي تفاصيل حول النواة. | يوفر نموذج رثرفورد للذرة تفاصيل حول نواة الذرة وموقعها داخل الذرة. |
| موقع الإلكترونات | |
| وفقا لطومسون نموذج الذرة، يتم تضمين الإلكترونات في مادة صلبة. | نموذج رثرفورد يقول الإلكترونات تقع حول النواة. |
| المدارات | |
| نموذج طومسون للذرة لا يعطي تفاصيل حول المدارات. | يوضح نموذج رثرفورد للذرة حول المدارات وأن الإلكترونات موجودة في هذه المدارات. |
| الكتلة | |
| يشرح نموذج طومسون للذرة أن كتلة الذرة هي كتلة الكتلة المشحونة إيجابيا حيث تكون الإلكترونات جزءا لا يتجزأ منها. | وفقا لنموذج رثرفورد للذرة، تتركز كتلة الذرة في نواة الذرة. |
ملخص - طومسون فس رثرفورد نماذج من أتوم
طومسون وروثرفورد نماذج من الذرة كانت أقدم النماذج لشرح هيكل الذرة. بعد اكتشاف الإلكترون من قبل J.J. تومسون، اقترح نموذجا لشرح هيكل الذرة. في وقت لاحق، اكتشف روثرفورد النواة وقدم نموذجا جديدا باستخدام كل من الإلكترون والنواة. والفرق الرئيسي بين طومسون ونموذج رذرفورد للذرة هو أن طومسون نموذج الذرة لا يحتوي على أية تفاصيل حول النواة في حين نموذج رذرفورد للذرة يفسر حول نواة الذرة.
تحميل نسخة بدف من طومسون فس رثرفورد نماذج من أتوم
يمكنك تحميل نسخة بدف من هذا المقال واستخدامها لأغراض حاليا كما في ملاحظات الاقتباس. يرجى تحميل نسخة بدف هنا الفرق بين طومسون و رثرفورد نموذج أتوم.
المرجع:
1. "روثرفورد نموذج من الذرة: تعريف ورسم تخطيطي. " دراسة. كوم. ن. د. على شبكة الإنترنت. متاح هنا. 06 يونيو 2017.
2. بريشيا، فرانك. أساسيات الكيمياء: مقدمة حديثة (1966). إلزيفير، 2012. برينت.
3. غولدسبي، كينيث. كيمياء. 12th إد. نيو يورك: مغراو-هيل، 2015. برينت.
إيماج كورتيسي:
1. "بلوم بودنغ أتوم" (بوبليك دومين) عبر كومونس ويكيميديا
2. "روثرفورد أتوم" بي أون أون وورك (كريتجودر شد شد) (سيسي بي-سا 3. 0) من خلال كومونس ويكيميديا
3. "نتائج روثرفورد الذهب احباط التجربة" من قبل المستخدم: فاستفيسيون عمل الخاصة (المجال العام) عن طريق كومونس ويكيميديا