الفرق بين عناصر S و P بلوك إليمنتس | S مقابل عناصر كتلة P
الفرق الرئيسي - S مقابل عناصر الكتلة P
يمكن تفسير الفرق الرئيسي بين عناصر كتلة s و p باستخدام التكوين الإلكتروني. في عناصر الكتلة s، يملأ الإلكترون الأخير إلى سوبسيل و s عناصر الكتلة، يملأ آخر الإلكترون إلى p سوبسيل. عندما تشكل الأيونات. s إزالة إلكتروناتها من أبعد s قبة تحتية بسهولة في حين أن عناصر كتلة ف تقبل الإلكترونات إلى ف سوبزيل أو إزالة الإلكترونات من ف-سوبشيل. وتشكل بعض العناصر الموجودة في المجموعة P أيونات موجبة تزيل الإلكترونات من الجزء السفلي من الطبقة الفوقية وبعض العناصر (العناصر الأكثر إلكترونيا) تشكل أيونات سلبية تقبل الإلكترون من الآخرين. عند النظر في الخصائص الكيميائية، هناك فرق كبير بين s و p عناصر كتلة؛ وهذا يرجع أساسا إلى تكوين الإلكترون.
ما هي عناصر S-بلوك؟
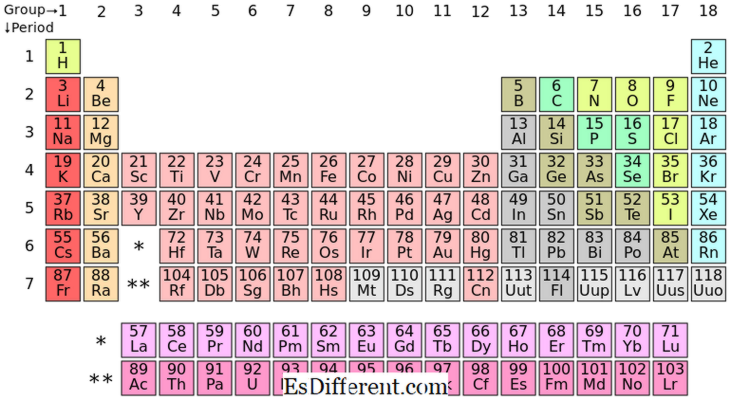
عناصر كتلة S هي العناصر الكيميائية في المجموعة الأولى والمجموعة الثانية في الجدول الدوري. وبما أن S سوبشيل يمكن أن تستوعب اثنين فقط من الإلكترونات، وعادة ما يكون لهذه العناصر واحد (المجموعة الأولى) أو اثنين (المجموعة الثانية) الإلكترونات في القشرة الخارجية. وترد العناصر في المجموعة الأولى والثانية أعلاه في الجدول.
Article Article Article Article <<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<< K| كاليفورنيا | 5 | |
| الروبيديوم | الأب | 6 |
| جيم | با | 7 |
| الاب | رع | - 2>> |
| يا | المعادن القلوية | إي A |
| المعادن القلوية الأرض | جميع العناصر في S- كتلة شكل الأيونات الموجبة وأنها تفاعلية جدا. | وضع عناصر S-بلوك في الجدول الدوري |
| |
ما هي عناصر P-بلوك؟ | عناصر الفدرة هي العناصر التي يملأها الإلكترون الأخير في سوبسيل. وهناك ثلاثة مدارات ف؛ يمكن لكل مداري استيعاب اثنين من الإلكترونات، مما يجعل ما مجموعه ستة P- الإلكترونات. لذلك، عناصر كتلة P لديها واحد إلى ستة ف الإلكترونات في قشرتها الخارجية. P- كتلة تحتوي على كل من المعادن وغير المعادن. بالإضافة إلى ذلك هناك بعض ميتالوادس أيضا. |
| 14 | 15 |
| 16 | 17 |
18
2
BC
N
| O | F ني | 3 | شركة | سي | P | |
| S | الكلورين | هارون | 4 | جا | قه | و |
| سي | برازيلي | الخمير الحمر | 5 | في | القصدير | بينالي الشارقة |
| تي | I | اكس | 6 | يرة تركية | الرصاص بي | بو |
| في | رن | ما هو الفرق بين S و P بلوك إليمنتس؟ | تكوين الكترون المشترك: | عناصر كتلة S: | تحتوي عناصر كتلة S على تكوين الإلكترون المشترك ل [نوبل غاس] نس | 1 |
| (لعناصر المجموعة الأولى) و [الغاز النبيل] نس | 2 | (لعناصر المجموعة الثانية). | عناصر الكتلة الفوقية: | تحتوي عناصر الكتلة P على تكوين الإلكترون المشترك ل [نوبل غاس] نس | 2 | نب |
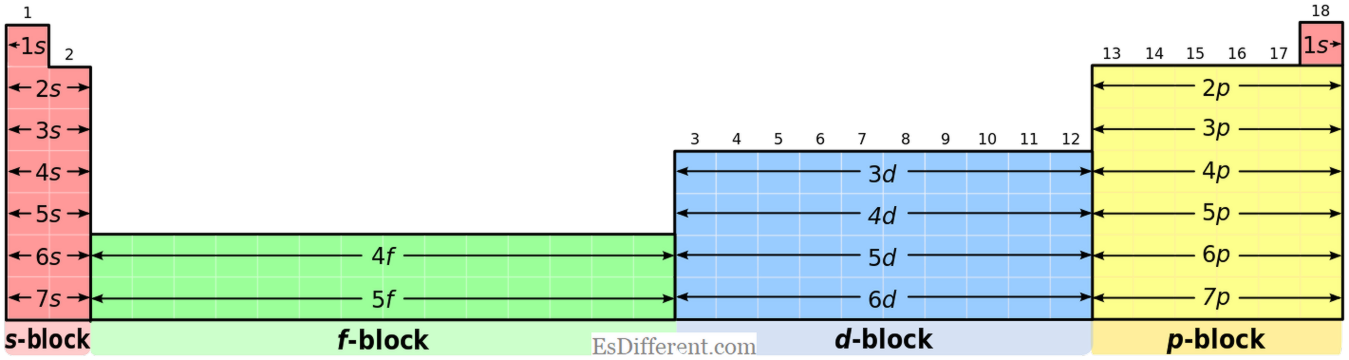
1-6
. ولكن، الهيليوم لديها 1s
2 التكوين؛ بل هو وضع خاص. الدول الأكسدة: عناصر كتلة S: عناصر S- كتلة لا تظهر حالات الأكسدة متعددة مثل عناصر كتلة P. على سبيل المثال، تظهر عناصر المجموعة الأولى +1 حالة الأكسدة والعناصر المجموعة الثانية تظهر +2 حالة الأكسدة. عناصر الكتلة الفوقية:
خلافا للعناصر s-بلوك، فإن عناصر p-بلوك لها حالة أكسدة مشتركة للمجموعة الخاصة بها في الجدول الدوري وبعض حالات الأكسدة الإضافية الأخرى اعتمادا على ثبات الأيونات. مجموعة 13 14 15 16 17 18
جينيرال إليكترون كونفيغوراتيون
نس 2
نب < م



