الفرق بين النترات والنتريت
نترات مقابل النتريت
كل من النترات والنتريت هي أوكسي أنيون من النيتروجين. على الرغم من أن كلا يبدو أن تبدو على حد سواء، وهناك اختلافات بينهما. ويمكن أن تكون هذه الاختلافات فيما يتعلق بهيكلها، والترابط، والشكل الهندسي، وحالة الأكسدة النيتروجين، التفاعل الكيميائي، واستخداماتها وغيرها. وتناقش هذه الاختلافات أساسا هنا.
لا 3 - أيون هي القاعدة المترافقة من هنو 3 (حمض النيتريك الخامس) وهو حمض قوي. هو جزيء مستوي مع سب 3 التهجين في ذرة النيتروجين. جميع ذرات الأكسجين الثلاثة مكافئة. هناك 24 الإلكترونات في قذائف التكافؤ. نو 3 - أيون لديه الوزن الجزيئي من 62. 004 g مول -1 .
لا 2 - أيون هي القاعدة المترافقة من هنو 2 (حمض النتريك الثالث) وهو حمض ضعيف (يكا = 3. بل هو أيضا جزيء مستوي مع سب 2 التهجين. في قذائف التكافؤ، هناك 18 الإلكترونات فقط. نو 2 - أيون لديه الوزن الجزيئي 46. 006 g مول -1 .
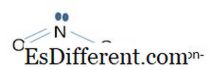

عندما يؤخذ الترابط في كل من الأيونات بعين الاعتبار، لا يوجد 3 - أيون ذي بي كوندينغ يتضمن أربعة 2p z أوربيتلا من N وثلاثة مدارات من 3 ذرات الأكسجين). وتشكل هذه المدارات الذرية الأربعة أربعة مدارات جزيئية ثنائية المحور. المدار الجزيئي مع أدنى طاقة هو المدار الترابط. المدار مع أكبر طاقة هو المدار المضادة للترابط. وهناك مدارتان أخريان تتدهوران (متساوية في الطاقة) وهما مدارتان غير مترابطتين. في حالة عدم وجود 2 - أيون، فإن الربط بي لا يتضمن سوى 3p z المدارات الذرية. هنا، المداري مع أدنى طاقة هو المداري الترابط، واحد هو المدار غير الترابط، والآخر هو المدار المضادة للترابط. في كل من الأيونات، والمدارات الترابط تنطوي في جعل σ السندات (سيغما السندات) والمدارات غير الترابط تنطوي في جعل π السندات (بي السندات). لذلك، في نو 3 - أيون كل سند لديه ترتيب السندات 1 1 / 3 . 1 من σ-السندات و 1 / 3 من π-السندات. في 2 - أيون، طلب السندات هو 1 1 / 2 . 1 من σ-السندات و 1 / 2 من π- السندات.
على الرغم من أن كلا الأيونات من نفس الهندسة الإلكترونية، حيث يختلف ترتيب السندات، فإن الأشكال الهندسية تختلف أيضا. 3 - أيون لديه شكل مستطيل مثلث و نو 2 - أيون لديه شكل زاوي (أو V شكل). زوايا السندات هي أيضا مختلفة. أونو <> 3 - أيون و نو 2 - أيون هي 120 0 و 115 0 على التوالي. حالة الأكسدة النيتروجين في كل من نو 3 - أيون و نو 2 - أيون +5 و +3 على التوالي.وبسبب هذه الأسباب (لا سيما الفرق في الترابط)، فإن التفاعل الكيميائي (مثل الأساسيات، القدرة المؤكسدة / الخفضية، منتجات التحلل الحراري للمركبات المكونة من هذه الأيونات) يختلف أيضا. في الواقع، لا
2 - أيون هو قاعدة أضعف في حين لا 3 - أيون هو قاعدة أضعف جدا. عندما تؤخذ في الاعتبار حالة الأكسدة من ذرة النيتروجين في هذه الأيونات في الاعتبار، لا 2 - أيون يمكن أن تعمل كعامل مختزل وكذلك عامل مؤكسد في حين لا 3 - أيون يمكن أن تعمل فقط كعامل مؤكسد. الأمثلة على المنتجات المتحصل عليها من التحلل الحراري لا

3 - ولا 2 - الأيونات التي تحتوي على مركبات مبينة أدناه لإظهار الفرق في التفاعل. حتى عندما تشكل مجمعات مع أيونات معدنية فإنها تتصرف بطريقة مختلفة. وهذا هو، لا

2 - أيون بمثابة يجند مونودنتات في حين لا 3 - أيون بمثابة يجند بيندنت. هذه الاختلافات في التفاعل الكيميائي تساعدنا على التمييز بين استخداماتهم. فعلى سبيل المثال، تستخدم النتريت عادة في معالجة اللحوم (وتستخدم أحيانا النترات أيضا)، وتستخدم النترات لإنتاج المتفجرات. النترات تحدث بشكل طبيعي وهي سرطانية. ولكن النتريت ليست سرطانية.




