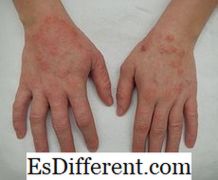
الفرق بين الجزيئات والشعرية
جزيء مقابل شعرية
الذرات الانضمام معا لتشكيل المواد الكيميائية المختلفة. وفقا لترتيبها تتغير ممتلكاتهم.
جزيء
جزيئات مصنوعة من خلال ربط كيميائي ذرات اثنين أو أكثر من نفس العنصر (على سبيل المثال: O 2 ، N 2 ) أو عناصر مختلفة (H 2 O، نه 3 ). جزيئات ليس لديها تهمة، والذرات هي المستعبدين السندات التساهمية. يمكن أن تكون الجزيئات كبيرة جدا (الهيموجلوبين) أو صغيرة جدا (H 2 )، اعتمادا على عدد من الذرات المتصلة. ويظهر نوع وعدد الذرات في جزيء من الصيغة الجزيئية. وتعطي الصيغة التجريبية أبسط نسبة صحيحة للذرات الموجودة في جزيء. على سبيل المثال، C 6 H 12 O 6 هي الصيغة الجزيئية للجلوكوز، و تش 2 O هي الصيغة التجريبية. الكتلة الجزيئية هي الكتلة المحسوبة بالنظر إلى العدد الإجمالي للذرات المعطاة في الصيغة الجزيئية. كل جزيء له هندسة خاصة به. يتم ترتيب الذرات في جزيء بطريقة أكثر استقرارا مع زاوية السندات محددة وأطوال السندات لتقليل التنافر والقوى اجهاد.
شعريةشعرية هي ظاهرة رياضية. في الكيمياء، يمكننا أن نرى أنواع مختلفة من الشبكات الأيونية وتساهمية. يمكن تعريف لاتيس بأنها صلبة التي لديها ترتيب ترتيب ثلاثي الأبعاد من الوحدات الأساسية. يمكن أن تكون الوحدة الأساسية ذرة أو جزيء أو أيون. المشابك هي الهياكل البلورية مع هذه الوحدات الأساسية المتكررة. عندما انضمت الأيونات مع السندات الأيونية، فإنها تشكل البلورات الأيونية. على سبيل المثال، كلوريد الصوديوم يمكن اتخاذها. الصوديوم هو مجموعة 1 المعادن، وبالتالي يشكل كاتيون +1 اتهم. الكلور هو اللافلزية ولها القدرة على تشكيل أنيون -1 مشحونة. في الشبكية، ويحيط كل أيون الصوديوم من قبل ستة أيونات الكلوريد، ويحيط كل أيون كلوريد من قبل ستة أيونات الصوديوم. نظرا لجميع عوامل الجذب بين الأيونات، هيكل شعرية أكثر استقرارا. عدد الأيونات الموجودة في شعرية يختلف مع حجم منه. شعرية الطاقة أو إنثالبي من شعرية هو مقياس قوة الروابط الأيونية في شعرية. إنثالبي شعرية عادة هو الطاردة للحرارة.