الفرق بين أوكت و دوبليت | أوكتيت فس دوبليت
فارق الاختلاف - أوكتت مقابل دوبليت
هناك ذرات أو مركبات نشطة كيميائيا وغير نشطة موجودة في الطبيعة. هذه الخاصية تعتمد بشكل أساسي على عدد الإلكترونات الموجودة في القشرة الخارجية للذرات. قد تصبح الذرات التي لها قذائف غير مكتملة نشطة من أجل استكمال تكوين الإلكترون لتصبح مستقرة. الذرات التي هي غير نشطة لديها تكوين الإلكترون كاملة. وبالتالي، فإن هذه الذرات لا تتفاعل مع أي ذرة أخرى إلا في ظروف خاصة. الغازات النبيلة هي دائما غير نشطة في الطبيعة. وبالتالي، فإنها تعرف باسم الغازات الخاملة. الغازات الخاملة موجودة في العمود الثامن في الجدول الدوري. وتميل العناصر الأخرى في نفس الفترة (الصف) إلى الحصول على تكوين الإلكترون للغاز الخامل في نهاية تلك الفترة، وهو الشكل الأكثر استقرارا في الطبيعة. الذرات النشطة تميل إلى إكمال عدد الإلكترونات وفقا ل قاعدة ثماني أو قاعدة دوبليت . والفرق الرئيسي بين الثماني والقرص الصغير هو أن الثماني هو ذرة أو أيون يحتوي على ثمانية إلكترونات كحد أقصى في القشرة الخارجية في حين أن دوبليت هو ذرة له الحد الأقصى من إلكترونات في القشرة الخارجية.
المحتويات
1. نظرة عامة والفرق الرئيسي
2. ما هو أوكت
3. ما هو دوبليت
4. جنبا إلى جنب مقارنة - أوكت مقابل دوبليت
5. ملخص
ما هو أوكتيت؟
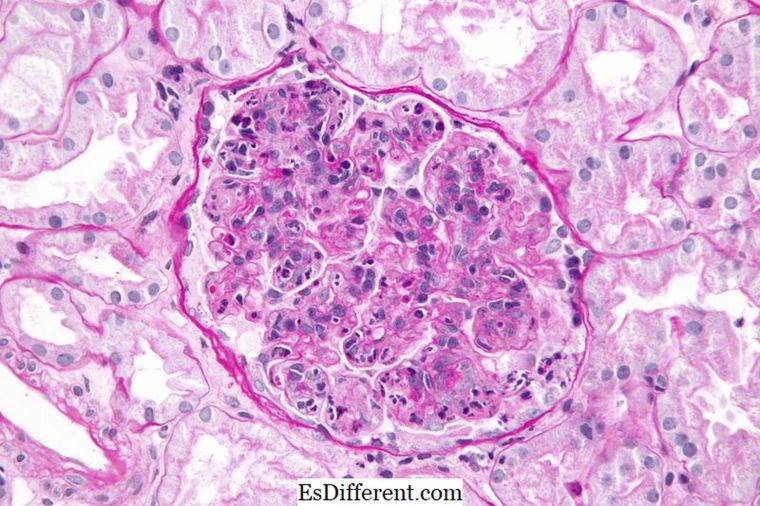
الثماني هو ذرة أو أيون يحتوي على ثمانية إلكترونات في القشرة الخارجية لتلك الذرة. جميع الغازات النبيلة باستثناء الهيليوم لديها ثمانية إلكترونات وهي خاملة في الطبيعة. التكوين الإلكترون من الغاز النبيل سوف تنتهي دائما على النحو التالي.
- 2>>نس 2 نب 6
على سبيل المثال، تكوين الإلكترون نيون هو 1s 2 2s 2 2P 6 . النيون هو غاز خامل.
عناصر أخرى لها سبعة، ستة، الخ. الإلكترونات في المدار الخارجي يميل إلى طاعة قاعدة الثماني عن طريق الحصول على الإلكترونات من الخارج؛ وبعض العناصر الأخرى وجود واحد، اثنين، الخ الإلكترونات تميل إلى فقدان الإلكترونات والحصول على تكوين الإلكترون من أقرب الغاز الخامل. ولكن عناصر أخرى في منتصف الجدول الدوري سوف تشكل روابط جديدة مع عناصر وجود الإلكترونات الزائدة لتبادل تلك الإلكترونات وتصبح ثماني.
الشكل 01: النيون، ثماني
ما هو دوبليت؟
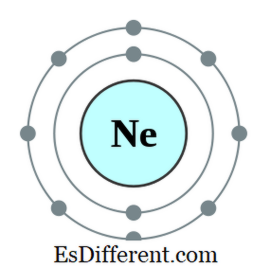
ذرة الهيدروجين و ذرة الهيليوم هي أصغر العناصر في الطبيعة ولها مداري واحد فقط حول نواتها. ويسمى هذا المدار 1s المداري. ويمكن أن يحتوي هذا المدار على إثنين من الإلكترونات كحد أقصى. ذرة الهيدروجين لديها إلكترون واحد والهيليوم اثنين من الإلكترونات. وبالتالي، يطلق على الهيليوم كومة صغيرة.الهليوم لديه أقصى عدد من الإلكترونات التي يمكن أن يكون. وبالتالي فهو عنصر مستقر في الطبيعة. ولذلك، الهليوم هو أيضا غاز خامل. ولكن الهيدروجين لديه إلكترون واحد فقط والمدار الوحيد هو غير مكتملة. وهكذا، ذرة الهيدروجين وحدها هي رد الفعل جدا وأنها تميل إلى تشكيل الرابطة التساهمية مع ذرة الهيدروجين آخر من خلال تقاسم الإلكترونات الوحيدة لديهم. ثم تصبح ذرات الهيدروجين مخططة، حيث أن لديها الآن إلكترونات في مداراتها الخارجية. ولكن الليثيوم يمكن أن تتصرف أيضا كدليل عن طريق إزالة الإلكترون من المدار الخارجي. تكوين الإلكترون من ليثيوم هو 1s 2 2s 1 . عن طريق إزالة 2S 1 الإلكترون، يمكن أن تصبح دبليه. في هذه الحالة، هي
2
الشكل 02: هيليوم، a دوبليت ما هو الفرق بين أوكت و دوبليت؟

- ديف المادة قبل منتصف الجدول ->
ثماني مقابل دوبليت
ثمانية ثماني إلكترونات في القشرة الخارجية.
دوبليت لديه إلكترونين في القشرة الخارجية. |
|
| كومون إليكترون كونفيغوراتيون | أوكتيت هاس نس |
| 2 | |
| نب 6 اكتب إلكترون التكوين في النهاية. دوبليت لديه نس 2 | نوع التكوين في النهاية. عدد المدارات قد يكون للثاني مداريان على الأقل. |
| يحتوي الجريدة على مداري واحد فقط. | |
| نوع من المدارات | يمكن أن يكون الثمانية جميع أنواع المدارات مثل s، p، d، f، الخ. |
| دوبليت لديه مداري فقط. | |
| ملخص - أوكتيت فس دوبليت | جميع العناصر تميل إلى أن تصبح مستقرة. ولكن مع تكوينات الإلكترون غير مكتملة، والذرات لا يمكن أن تكون مستقرة. وبالتالي، فإنها تصبح رد الفعل جدا من أجل ملء قذائف مع الإلكترونات عن طريق كسب، فقدان أو تقاسم الإلكترونات. الذرات أو الجزيئات التي تطيع ثماني أو حكم دوبليت مستقرة. والفرق الرئيسي بين الثماني والقطيع هو أن الثماني ثمانية إلكترونات في المدار الخارجي لها في حين أن دوبليت له إلكترونين في مداره. |
المراجع:
1. نيما، P.، 2011. توبرلارنينغ. [أونلين] متاح على: هتب: // ووو. topperlearning. كوم / فورمز / هوم-وورك-هيلب-19 / وات-إس-أوكت-دوبليت-فالنسي-أند-أيونز-تشيميستري-ستروكتور-ذي-ذي-أتوم-46317 / ريبلي [أسسد 29 05 2017].
2. تشانغ، R.، 2010. الكيمياء. 10th إد. نيويورك: ماكجرو هيل.
3. حالا. ، 2015. الصف مكدس. [أونلين] متاح على: هتب: // غرادستاك. / نتس-كومبليت-كورس / تشيميكال-بوندينغ / تشيميكال-أكتيفيتي-أوف-أن / 19176-3853-37737-ستودي-وتو [أسسد 29 05 2017].
إيماج كورتيسي:
1. "إلكترون شل 002 هيليوم - نو لابيل" بواسطة بومبا (العمل الأصلي من قبل جريج روبسون) - المخططات الإلكترون قذيفة (نسخة المسمى المسمى) (سيسي بي-سا 2. 0 أوك) عبر ويكومديا كومونس
2. "إليكترون شل 010 نيون" بواسطة بومبا (العمل الأصلي من قبل جريج روبسون) (سيسي بي-سا 2. 0 أوك) عبر ويكومديا كومونس