الفرق بين التحليل المائي والتكثيف
التحلل المائي مقابل التكثيف
التكثيف والتحلل المائي هما نوعان من التفاعلات الكيميائية، التي تشارك في تكوين السندات وكسر السندات. التكثيف هو عكس التحلل المائي. وهذان النوعان من التفاعلات موجودان عادة في النظم البيولوجية، كما نستخدم هذه التفاعلات للحصول على العديد من المنتجات ذات الأهمية التجارية.
- <>التكثيف
تفاعلات التكثيف هي نوع من التفاعل الكيميائي حيث تتجمع الجزيئات الصغيرة لتشكيل جزيء واحد كبير. يحدث التفاعل داخل مجموعتين وظيفيتين في الجزيئات. سمة مميزة أخرى من رد فعل التكثيف هو أن جزيء صغير يتم فقدان أثناء التفاعل. يمكن أن يكون هذا الجزيء الماء، وكلوريد الهيدروجين، وحمض الخليك، وما إذا كان الجزيء المفقود هو الماء، وهذه الأنواع من ردود الفعل التكثيف تعرف باسم ردود الفعل الجفاف. وبما أن الجزيئات المتفاعلة أصغر وجزيء المنتج كبير جدا، فإن كثافة المنتجات ستكون دائما أعلى من ردود الفعل في تفاعلات التكثيف. تحدث تفاعلات التكثيف بعدة طرق. على سبيل المثال، يمكننا تقسيم على نطاق واسع هذه إلى نوعين مثل التفاعلات التكثيف بين الجزيئات وردود الفعل التكثيف داخل الجزيئية. إذا كانت المجموعتان الوظيفيتان مقيما في نفس الجزيء، فإنهما يعرفان بالتكثفات داخل الجزيئات. على سبيل المثال، الجلوكوز له هيكل خطي كما يلي.
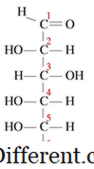
في محلول، معظم الجزيئات في هيكل دوري. عندما يتم تشكيل هيكل دوري، يتم تحويل -OH على الكربون 5 في الربط الأثير، لإغلاق حلقة مع الكربون 1. هذا يشكل ستة أعضاء هيكل حلقة هيمياسيتال. خلال هذا التفاعل التكثيف الجزيئي داخل، يتم صد جزيء الماء، ويتم تشكيل الربط الأثير. التفاعلات بين الجزيئات تنتج العديد من المنتجات المفيدة والمشتركة. خلال هذا، يحدث التفاعل بين المجموعات الوظيفية لجزيئين منفصلين. على سبيل المثال، عند تشكيل جزيء مثل البروتين، والأحماض الأمينية هي مكثفة. يتم تحرير جزيء الماء، ويتم تشكيل ارتباط أميد الذي يعرف باسم رابطة الببتيد. عندما يرتبط اثنين من الأحماض الأمينية معا، يتم تشكيل الببتيد، وعندما انضم العديد من الأحماض الأمينية يسمى ببتيد. الحمض النووي و الحمض النووي الريبي هي أيضا اثنين من الجزيئات تشكلت نتيجة تفاعلات التكثيف بين النيوكليوتيدات. ردود الفعل التكثيف تنتج جزيئات كبيرة جدا وأحيانا الجزيئات ليست كبيرة جدا. على سبيل المثال: في تفاعل استرة بين الكحول وحمض الكربوكسيلية، جزيء استر صغير إذا شكلت. التكثيف مهم في تشكيل البوليمر. البوليمرات هي جزيئات كبيرة، والتي لديها نفس الوحدة الهيكلية تكرار مرارا وتكرارا.وتسمى الوحدات المتكررة مونومرات. وترتبط هذه المونومرات مع بعضها البعض مع السندات التساهمية لتشكيل البوليمر.
التحلل
هذا هو رد فعل حيث يتم كسر الرابطة الكيميائية باستخدام جزيء الماء. خلال هذا التفاعل، ينقسم جزيء الماء إلى بروتون و أيون هيدروكسيد. ثم تضاف هذه الأيونات إلى جزأين من الجزيء حيث يتم كسر السندات. على سبيل المثال، التالي هو استر. السندات استر بين -CO و -O.

في التحلل المائي، يضاف البروتون من الماء إلى الجانب -O، ويضيف أيون هيدروكسيد إلى الجانب -CO. ولذلك، ونتيجة للتحلل المائي، والكحول وحمض الكربوكسيلية تشكل التي كانت المتفاعلات عند تشكيل استر.
|
ما هو الفرق بين التحلل والتكثيف؟ • التحلل هو عكس التكثيف. • تفاعلات التكثيف تجعل الروابط الكيميائية في حين أن التحلل المائي يكسر الروابط الكيميائية. • يتم إجراء البوليمرات عن طريق تفاعلات التكثيف، ويتم تكسيرها بواسطة تفاعلات التحلل المائي. • خلال تفاعلات التكثيف، يمكن إطلاق جزيء الماء. في تفاعلات التحلل المائي، يتم دمج جزيء الماء في الجزيء. |


