الفرق بين عناصر كتلة العناصر وعناصر الانتقال | D بلوك إليمنتس مقابل العناصر الانتقالية
الفرق الرئيسي - D عناصر الكتلة مقابل العناصر الانتقالية
الفرق بين عناصر D- عناصر مربكة تماما. وتستخدم كلتا الكلمتين بالتبادل، ويستخدم كثير من الناس كلمة 'عناصر انتقالية' لعناصر د-بلوك. الفرق الرئيسي بين عناصر D-بلوك وعناصر الانتقال هو أنه على الرغم من أن كل عناصر النقل هي عناصر D-بلوك ليست عناصر D-بلوك كلها عناصر نقل . ومن الواضح أن عناصر D- كتلة ديك الإلكترونات في قذيفة د الفرعية. عناصر التحولات هي العناصر التي تشكل أيونات مستقرة بعد أن ملأت بشكل كامل <- المدارات. على سبيل المثال، الزنك والسكنديوم هي عناصر د كتلة. ولكن ليس عناصر الانتقال.
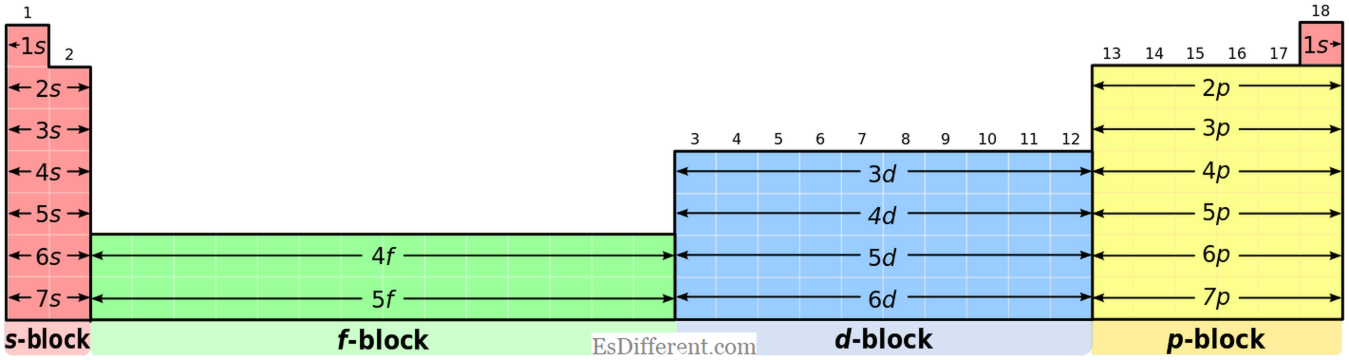
ما هيD-بلوك إليمنتس؟ يمكن تحديد عناصر D-بلوك بوضوح باستخدام تكوين الإلكترون وموقف الجدول الدوري. وتتمثل السمة الرئيسية لعنصر د-بلوك في وجود إلكترون واحد على الأقل في

d- سوب شل. يحدث الشيء الغريب عند ملء الإلكترونات وفقا ل أوفاو المبدأ في عناصر د-بلوك هو 4s - يتم أولا اختيار المكونات أولا 3d -electrons؛ وهو ما يعني 3D الإلكترونات لديها طاقة أعلى من 4S الإلكترونات. ولكن، عندما إزالة الإلكترونات لتشكيل الأيونات. 4s - تتم إزالة المكونات أولا من الذرة.
| الكترون | سكانديوم | |
| سك | [أر] 3d | 1 4s 2 |
| تي | تي | تي 2 4 ثانية 2 |
| الفاناديوم | V | [أر] 3d 3 4 ثانية < الكروم |
| كر | [أر] 3d | 5 4 ثانية 1 المنغنيز |
| من | 2 فيروس في [أر] 3d | |
| 6 | 4 ثانية | 2 الكوبالت < 4s 2 |
| نيكل | ني | [أر] 3d 8 4 ثانية 2 |
| النحاس < | 10 | 4s 1 الزنك زن |
| [أر] 3d | 10 | 4 ثانية 2 - <>> ملاحظة: |
| [أر] = 1s | 2 | 2s 2 2p 6 |
2 3p 6 ما هي العناصر الانتقالية؟ العناصر الانتقالية هي العناصر التي تشكل أيونات مستقرة مع مدارات مدارية غير كاملة. عندما يتم تشكيل الأيونات من قبل عناصر د كتلة. فإنها تزيل أولا s -electrons (n-ليفيل) ثم تزيل d -electrons (n-1 ليفيل). الزنك والسكنديوم هما عنصران خاصان في كتلة د. فإنها لا تشكل الأيونات التي ملأت بشكل كامل <- المدارات؛ وبالتالي فهي لا تعتبر عناصر انتقالية.جميع العناصر الأخرى في المجموعة د تشكل الأيونات المستقرة التي ملأت بشكل كامل d
-electrons.
الحلول المعدنية الانتقالية ما هو الفرق بين عناصر D-بلوك وعناصر الانتقال؟ تعريف عناصر D-بلوك والعناصر الانتقالية D-بلوك إليمنتس: العناصر التي تحتوي على واحد أو أكثر d- إلكترون في d- سوب شل تعرف باسم عناصر D-بلوك. معظم عناصر د كتلة هي المعادن.

العناصر الانتقالية:
العناصر التي يمكن أن تشكل الأيونات المستقرة التي تمت تعبئتها بشكل كامل
d
تسمى عناصر الأرتال. ملاحظة: زن و سك ليست عناصر انتقال. أنها لا تشكل سوى زن 2 + و سك 3 +
أيونات، والتي لا تحتوي على المدارات فارغة. الزنك 2+ = 1S
2
2S 2 2P 6 3S
2 3P 6 3D 10 الشوري 3+ = 1S 2 2S 2 2P 6 3S
2 3p 6 3D 10 تحتوي الأيونات التالية على مدارات غير مدورة. ولذلك، تعتبر هذه العناصر عناصر انتقالية. <السابق 1 2 3 4 5 6 7 التالي> 1 2 3 4 5 6 7 8 9 9 9 التالي> 3d 9 3 9000> 499 <2> 999 <2 2 2s < 3p
6
3d 6 2 2p 6 3s 2 3p 6 3d 5 في 2+ = 1s
2 2 ثانية < 2p 6 3s 2 3p 6 3d 6 الأكسدة: من عناصر D- كتلة تظهر حالات الأكسدة متعددة وعدد قليل منها تظهر حالة أكسدة واحدة. مثال: يظهر الزنك فقط +2 حالة الأكسدة و سكانديوم يظهر فقط +3 حالة الأكسدة.
عناصر أخرى في د كتلة تظهر حالات الأكسدة متعددة. العناصر الانتقالية: تظهر عناصر الانتقال حالات أكسدة متعددة. تحتوي حالة واحدة على الأقل على d غير مدفوعة. مثال: تيتانيوم +2، +4 فاناديوم +2، +3، +4، +5 كروميوم +2، +3، +6 المنغنيز +2، +3 ، +4، +6، +7 فيروس +2، +3 كوبالت +2، +3 نيكل +2، +4 نحاس +1، +2
إيماج كورتيسي: 1. "كتل الجدول الدوري سبديف (32 عمود)" من قبل المستخدم: ديبيب [سيسي بي-سا 3. 0] عبر العموم 2. "كولوريد-ترانزيتيون-ميتال-سولوتيونس" [بوبليك دومين] عبر كومونس


