الفرق بين التفاعل بين الاندماج والتحلل | تركيبة ضد تفاعل التحلل
الفرق الرئيسي - التفاعل بين التفاعلات التحللية
التفاعل الكيميائي هو تحويل واحد أو أكثر من المركبات الكيميائية إلى واحد أو أكثر منتجات مختلفة، وتغيير هوية مركب كيميائي. ويطلق على المادة الأولية للتفاعل الكيميائي المتفاعل ويسمى المركب الناتج بالمنتج. وسوف يحدث انهيار المركبات أو مزيج من المركبات وتشكيل مركبات جديدة خلال عملية التفاعل الكيميائي منذ يتم كسر الروابط بين ذرات المجمع وخلق بطريقة مختلفة. ويمكن تقسيم التفاعلات الكيميائية إلى عدة فئات عريضة. تفاعلات الأكسدة أو تفاعلات الحد من الأكسدة مهمة جدا فيما بينها. وتسمى تفاعلات الأكسدة والحد من ردود الفعل نقل الإلكترون منذ يتم نقل الإلكترونات من المفاعلات من مجمع واحد إلى الآخر لتسبب رد فعل. في تفاعلات الأكسدة، تحدث تفاعلان متوازيان، تسمىان نصف التفاعلات، في نفس الوقت. تظهر هذه التفاعلات نصف نقل الإلكترونات. من خلال تحقيق التوازن بين هذه ردود الفعل النصف، يمكن للمرء أن تخمين رد الفعل العام الذي حدث في نهاية المطاف. ردود الفعل مزيج وردود الفعل التحلل نوعان رئيسيان من تفاعلات الأكسدة والاختزال. والفرق الرئيسي بين تفاعل الاندماج والتحلل هو أن تفاعل التفاعل يشتمل على مزيج من المواد المتفاعلة لإعطاء منتج واحد في حين أن تفاعل التحلل ينطوي على انهيار مركب واحد في منتجين أو أكثر.
المحتويات
1. نظرة عامة والفرق الرئيسي
2. ما هو رد الفعل المختلط
3. ما هو رد فعل التحلل
4. جنبا إلى جنب المقارنة - الجمع بين مقابل التحلل رد الفعل
5. ملخص
ما هو رد الفعل مزيج؟
تفاعل التفاعل، الذي يطلق عليه أيضا تفاعل التوليف ، هو رد فعل يتم فيه تجميع المركبات المتفاعلة لتشكيل مركب مختلف مثل المنتج. وبعبارة أخرى، فإن تفاعل الجزيئات البسيطة يؤدي إلى جزيء معقد. يتم تقسيم بعض أو كل الروابط بين ذرات ذلك المركب المعين. في نفس الوقت، سوف تتجمع الذرات لتشكيل مجمع جديد، وهو المنتج. في تفاعلات التحلل، نفس المتفاعل بمثابة المواد بدءا لكل من ردود الفعل نصف.وخلافا لما يحدث في تفاعلات التحلل، فإن التفاعلات النصفية في التفاعلات المجمعة لها تفاعلات مختلفة لتبدأ. نتائج التفاعل مزيج في منتج واحد. وفيما يلي مثال شائع يمكن أن يعطى كرد فعل احتراق.
على سبيل المثال، عند وضع الألومنيوم (آل) في بروميد سائل (بر2 ) يحدث تفاعل مدمج وينتج بروميد الألومنيوم (ألبر 3 ). هنا، يتم زيادة عدد الأكسدة في آل وانخفض في بر. لذلك، هو رد فعل الأكسدة والاختلاط هو رد فعل مزيج منذ رد فعل اثنين من المتفاعلات لإعطاء منتج معين واحد. الشكل 01: رد الفعل المختلط
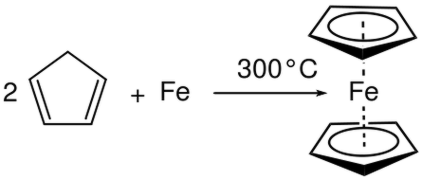
رد فعل التحلل هو رد فعل آخر مهم في فئة تفاعلات الأكسدة. هو في الأساس عكس رد الفعل مزيج. رد فعل التحلل هو رد فعل حيث يتم تقسيم مركب متفاعل أسفل إلى المنتجات. هنا، تحدث نصف ردود الفعل في نفس الوقت رد فعل الأكسدة و رد فعل الحد. ولكن خلافا للرد فعل تركيبة، المتفاعل لكل من ردود الفعل نصف هو نفسه في ردود الفعل التحلل. نتائج التفاعل التحلل في العديد من المنتجات.
في التحليل الكهربائي للمياه، عندما يتم تمرير التيار المباشر من خلال الماء، يتم تحلل جزيئات الماء لإعطاء غازات الأوكسجين والهيدروجين. هنا، يتم زيادة عدد الأكسدة في ذرة الأكسجين وينخفض في ذرة الهيدروجين. وبالتالي، هو رد فعل الأكسدة و رد فعل التحلل بسبب انهيار جزيئات الماء إلى أكسجين وهيدروجين غازات.
الشكل 02: تركيبة ضد التحلل

ما هو الفرق بين تفاعل الاندماج والتحلل؟
- ديف المادة قبل منتصف الجدول ->
الجمع بين مقابل التحلل رد الفعل
اثنين أو أكثر من المركبات المتفاعلة تشارك في ردود الفعل الجمع. |
|
| ويشترك مركب واحد في رد فعل التحلل. | المنتجات |
| مزيج رد فعل النتائج في منتج واحد. | |
| تؤدي تفاعلات التحلل إلى عدة منتجات. | ردود الفعل النصف |
| في ردود الفعل مجتمعة، واثنين من ردود الفعل نصف اثنين من جزيئات البداية المختلفة. | |
| في تفاعلات التحلل، يكون جزيء واحد بمثابة مادة البداية لكل من ردود الفعل النصف. | السندات الكيميائية |
| ردود الفعل مزيج يؤدي إلى الترابط من الذرات لإنتاج المنتج النهائي واحد. | |
| في التفاعلات التحلل، يتم تقسيم الروابط الكيميائية إلى أسفل لتشكيل اثنين أو أكثر من المنتجات النهائية. | جزيئات |
| تسبب تفاعلات الجمع بين الجزيئات البسيطة في التفاعل وإنتاج جزيئات معقدة. | |
| ردود الفعل التحلل تسبب جزيئات معقدة لكسر في جزيئات بسيطة. | ملخص - كومبيناتيون فس ديكومبوسيتيون رياكتيون |
ردود الأكسدة الأكسدة هي جزء كبير من العالم من حولنا لأن غالبية التفاعلات الكيميائية الهامة هي تفاعلات الأكسدة. ردود الفعل مزيج وردود الفعل التحلل هي ردود الفعل البسيطة التي هي عكس بعضها البعض. والفرق الرئيسي بين تفاعل الاندماج والتحلل هو أن تفاعل الاندماج يشتمل على مزيج من جزيئتين متفاعلتين أو أكثر من أجل أن ينتج عنه منتج نهائي واحد بينما يتضمن تفاعل التحلل انهيار جزيء واحد في منتجين أو أكثر.
المراجع:
1. تشانغ، R.، 2010. الكيمياء. 10th إد. نيويورك: ماكجرو هيل.
2. الأكسدة. (2009، 30 يوليو). استرجاع 29 مايو 2017، من هتبس: // ويكينتيراكتيونس. وورد. كوم / الاشعال / الأكسدة /
3. تفاعل. (د.). استرجاع 29 مايو 2017، من هتب: // شبكة الاتصالات العالمية. ريك. إيدو / فاكولتي / بتيسكوس / رياكتيونس /
إيماج كورتيسي:
1. "ميلر فيروسن سينثيز" بواسطة بيرت. كيلانوسكي - عمل خاص (CC0) عبر كومونس ويكيميديا
2. "تفاعلات كيميائية" بقلم دانيال بوغليسي - عمل خاص (سيسي بي-سا 3. 0) عن طريق كومونس ويكيميديا [999]