الفرق بين المعادلة المتوازنة والمعادلة الأيونية الصافية | المعادلة المتوازنة مقابل المعادلة الصافية الأيونية
فارق المفاتيح - المعادلة المتوازنة مقابل المعادلة الأيونية الصافية
يمكن كتابة جميع التفاعلات الكيميائية كمعادلة. مكونات هذه المعادلة تشمل المتفاعلات مع حالاتها المادية، سهم لإظهار اتجاه رد فعل ومنتجات التفاعل مع حالاتهم المادية. إذا كان هناك أي شروط خاصة المستخدمة، فهي مكتوبة أيضا لفترة وجيزة على السهم. إذا كان التفاعل في التوازن، يتم استخدام اثنين من الأسهم نصف في اتجاهات متعاكسة. يمكن كتابة معادلة كيميائية بطريقتين: معادلة متوازنة أو كمعادلة أيونية صافية. والفارق الرئيسي بين المعادلة المتوازنة والمعادلة الأيونية الصافية هو أن المعادلة المتوازنة تظهر جميع التفاعلات التي حدثت في نظام معا في حين أن المعادلة الأيونية الصافية تظهر فقط صافي التفاعل الذي حدث بعد الانتهاء من تلك المعادلة رد فعل.
المحتويات
1. نظرة عامة والفرق الرئيسي
2. ما هي المعادلة المتوازنة
3. ما هي المعادلة الصافية الأيونية
4. جنبا إلى جنب المقارنة - المعادلة المتوازنة مقابل صافي المعادلة الأيونية
5. ملخص
ما هي المعادلة المتوازنة؟
التفاعلات الكيميائية مهمة جدا في فهم سلوك نظام معين. من خلال كتابة المعادلة الصحيحة للتفاعل، يمكن للمرء أن يحصل على فكرة عن التغيرات في الأنواع المختلفة في هذا النظام. لردود الفعل البسيطة مثل حل كلوريد الصوديوم في الماء، يمكن كتابة المعادلة بسهولة من خلال التنبؤ بالمنتجات المحتملة لهذا التفاعل. ولكن لردود الفعل المعقدة الأخرى، قد يلزم إجراء المزيد من الاختبارات من أجل معرفة منتجات هذا النظام بعينه. ولكن في معظم الأوقات، من المرجح جدا أن تكون المعادلة المكتوبة غير متوازنة، مما يجعل من الصعب تفسير السلوك الكيميائي لذلك النظام. ولذلك، ينبغي أيضا أن تكون متوازنة المعادلات غير المتوازنة. وتشمل المعادلة المتوازنة جميع المواد المتفاعلة ومنتجات هذا النظام. تتم كتابة المعادلة من خلال النظر في المركب المتفاعل كجزيء. على سبيل المثال، فإن المعادلة المتوازنة بين كي و بنو 3 (إذا كانت تلك التفاعلات في الماء) ستكون؛

أهمية المعادلة المتوازنة هي أنها تكشف عن كميات المواد المتفاعلة التي يجب إضافتها مع إعطاء تفاصيل عن العلاقات المتكافئة بين الأنواع في النظام. في المثال أعلاه، يجب أن تكون النسبة بين بنو 3 و كي 1: 2 عند إضافة تلك المكونات إلى النظام.
ما هي "صافي المعادلة الأيونية"؟
تظهر المعادلة الصافية الأيونية فقط التفاعل الكلي الذي حدث في النظام. وهي تشمل الأنواع الأيونية والمنتجات المشكلة. ولكنها لا تشير إلى كل ردود الفعل التي حدثت في نظام معين. على سبيل المثال، إذا كان هناك تفاعل بين جزيئين باستخدام الماء كوسيط، قد تكون المركبات قد حلت في الماء وفصلها إلى أيونات. بعض هذه الأيونات قد تكون متورطة في التفاعل ولكن بعضها قد لا. ثم تشمل المعادلة الأيونية الصافية فقط الأيونات التي شاركت في تفاعل صاف. وتزيل الأيونات الأخرى، التي تسمى أيونات المشاهد، من المعادلة للحصول على المعادلة الأيونية الصافية. على سبيل المثال، إذا تفاعلت كي و بنو 3 في الماء، فإن التفاعل الأيوني الصافي سيكون؛
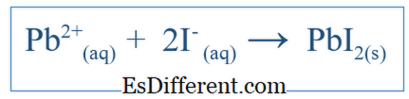
وينبغي أن يشمل هذا أيضا + أيون و NO3 - أيون، ولكن هذه الأيونات سوف تذوب فقط ولا تشارك في التفاعل الرئيسي؛ وبالتالي، فهي ليست مدرجة في صافي رد الفعل الأيونية.
ما هو الفرق بين المعادلة المتوازنة والمعادلة الأيونية الصافية؟
- ديف المادة قبل الجدول ->
المعادلة المتوازنة مقابل المعادلة الأيونية الصافية |
|
| جميع المكونات التي تم استخدامها تكتب كمفاعلات في المعادلة المتوازنة. | سوف تكتب المفاعلات التي كانت تشارك فقط في التفاعل الصافي في التفاعل الأيوني الصافي. |
| المنتجات | |
| يتم تضمين جميع المكونات في نهاية التفاعل في معادلة متوازنة. | في المعادلة الأيونية الصافية، تتم كتابة المنتج النهائي الصافي فقط. |
| التفاصيل جيفن | |
| المعادلة المتوازنة تعطي تفاصيل عن جميع الأنواع الموجودة في النظام. | المعادلة الصافية الأيونية تعطي تفاصيل فقط عن الأنواع التي شاركت في التفاعل |
الملخص - المعادلة المتوازنة مقابل المعادلة الأيونية الصافية
عند إضافة مركبات أيونية معينة إلى الماء، فإنها تفكك وتشكل أيونات تذوب في الماء. وهذا ينتج الأنيونات والكاتيونات. لإظهار الأنواع المنتجة بعد الانتهاء من التفاعل واتجاه التفاعل، يمكن كتابة معادلة كيميائية. هذه المعادلة يمكن أن تكون متوازنة بالنظر إلى عدد الذرات من كل الأنواع التي تقع على جانبي السهم. أحيانا، حتى تهمة تلك الأنواع ينبغي النظر فيها. وهذا يعطي معادلة كيميائية متوازنة لهذا النظام بعينه. ومع ذلك، فإن المعادلة الأيونية الصافية تشمل فقط الأنواع المتفاعلة. وكما ذكر سابقا، فإن الاختلاف الأساسي بين المعادلة المتوازنة والمعادلة الأيونية الصافية هو أن المعادلة المتوازنة تظهر كل التفاعلات في النظام بينما تظهر المعادلة الأيونية الصافية فقط التفاعل الصافي الذي حدث عند إكمال التفاعل المعين.
المراجع:
1. تشانغ، R.، 2010. الكيمياء. 10th إد. نيويورك: ماكجرو هيل.
2. التفاعلات الكيميائية. (د.). استرجاع 26 مايو 2017، من هتب: // شبكة الاتصالات العالمية. ريك. ايدو / كلية / ptiskus / ردود الفعل /
3. كاملة الأيونية وصافي المعادلات الأيونية. (د.). استرجاع 26 مايو 2017، من هتبس: // شبكة الاتصالات العالمية. أكاديمية خان. غزاله / علوم / كيمياء / الكيميائية ردود الفعل stoichiome / أنواع من بين الكيميائية ردود الفعل / أ / كاملة الأيونية وصافي الأيونية-المعادلة.




