الفرق بين المعادن القلوية والمعادن القلوية للأرض | المعادن القلوية مقابل المعادن القلوية الأرض
المعادن القلوية مقابل المعادن القلوية للأرض < حيث أن كلا من الفلزات القلوية والفلزات القلوية الأرضية هما أول مجموعتين في الجدول الدوري، فإن الفرق بين الفلزات القلوية والفلزات القلوية الأرضية هو موضوع اهتمام لأي طالب كيمياء. وتسمى المعادن القلوية والفلزات القلوية الأرضية أيضا بعناصر "S-بلوك" لأن العناصر في كلتا المجموعتين لها إلكترون (أو أكثر) إلكتروناتها في الخلية الفرعية.
عموما، استخدمنا كلمة "معدن" للمواد التي تجري الكهرباء؛ كل من الفلزات القلوية والمعادن القلوية الأرضية هي موصلات كهربائية وحرارية جيدة. والعناصر في هاتين المجموعتين هي المعادن الأكثر تفاعلا في الجدول الدوري. نقاط انصهارها منخفضة نسبيا مقارنة مع المعادن الأخرى. المعادن القلوية والمعادن القلوية الأرضية لها خصائص مماثلة كثيرة، ولكن هذه المقالة تناقش أساسا الاختلافات بينهما.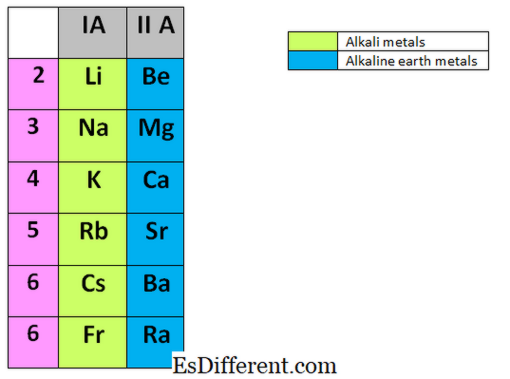
المعادن القلوية هي العناصر الموجودة في المجموعة الأولى من الجدول الدوري. وهي الليثيوم (لي) والصوديوم (نا) والبوتاسيوم (K)، روبيديوم (رب)، السيزيوم (كس) والفرنسيوم (فر). فهي جميعا معادن ومتفاعلة جدا ولا توجد أي من هذه الفلزات على أنها معادن حرة في الطبيعة. يتم تخزين المعادن القلوية دائما في سوائل خاملة مثل الكيروسين لأنها تتفاعل بسرعة مع الهواء وبخار الماء والأكسجين في الهواء. في بعض الأحيان أنها تتفاعل بشكل متفجر مع المواد الأخرى. أنها يمكن أن تحقق حالة الغاز النبيل بسهولة، عن طريق إزالة الإلكترونات في نهاية المطاف في قذيفة التكافؤ.
2 CO3، هيدروكسيد الصوديوم) هي مهمة جدا تجاريا. ما هي المعادن القلوية الأرض؟
توجد المعادن الأرضية القلوية في المجموعة الثانية من الجدول الدوري. وتشمل عناصر المجموعة الثانية؛ البريليوم (بي)، المغنيسيوم (المغنيسيوم)، الكالسيوم (كا)، السترونتيوم (سر)، الباريوم (با) وراديوم (را). على غرار المعادن القلوية، وهذه العناصر أيضا لا تحدث بحرية في الطبيعة، وأنها أيضا رد الفعل جدا.
جميع العناصر في هذه المجموعة هي أكثر كثافة من الماء. المعادن الصرفة اللون الرمادي الفضي، ولكنها تميل إلى إزالة اللون بسرعة عندما تتعرض للهواء لأنها تشكل طبقة أكسيد على السطح. مثل المعادن القلوية، وهذه المعادن هي أيضا موصلات جيدة في الحرارة والكهرباء.جميع المعادن القلوية الأرضية ذات قيمة تجارية.
ما هو الفرق بين المعادن القلوية والمعادن القلوية الأرضية؟
الإلكترون
- : المعادن القلوية لديها التكوين الإلكتروني ل [نوبل غاس] نس 1 والمعادن القلوية الأرضية لديها، [الغاز النبيل] نس 2 التكوين الإلكتروني. فالينس
- : تحتوي جميع الفلزات القلوية على إلكترون في قشرتها الخارجية، ولجميع الفلزات الأرضية القلوية إلكترونات خارجية. ولتحقيق تكوين الغاز النبيل، تحتاج المعادن القلوية إلى فقدان إلكترون واحد (فالنس هو "واحد")، في حين أن الفلزات الأرضية القلوية تحتاج إلى إزالة إلكترونين (التكافؤ هو "اثنين"). تفاعلية
- : كل من الفلزات القلوية والمعادن القلوية متفاعلة جدا. تعد المعادن القلوية أكثر تفاعلا من الفلزات الأرضية القلوية. الأيونية تهمة
- : المعادن القلوية لديها +1 الأيونية تهمة في المركبات والفلزات الأرضية القلوية لديها +2 الأيونية تهمة في المركبات. صلابة
- : الفلزات القلوية لينة جدا ويمكن قطعها بسكين حاد. الفلزات القلوية الأرضية هي أصعب من المعادن القلوية. ملخص:
المعادن القلوية مقابل القلوية الأرض المعادن



