الفرق بين الضغط الجزئي وضغط البخار الفرق بين الضغط
ويستخدم الضغط الجزئي وضغط البخار بشكل شائع المصطلحات العلمية المتعلقة بمقدار الضغط الذي تمارسه مكونات النظام، ولكن هويتهم يمكن أن تكون مربكة للآخرين. وهناك تمييز واضح بين هذه المصطلحات بما في ذلك آثارها وهويتها. وستوضح هذه المادة بالتفصيل الاختلافات بين هذه المصطلحات. وستتضمن أيضا بعض الأمثلة لإزالة الغموض عن تطبيقاتها.
دعونا نبدأ من خلال تسليط الضوء على مفهوم الضغط قبل أن نتمكن من الخوض في التمييز بين البخار والضغط الجزئي. يتم تعريف الضغط علميا على أنها القوة المطبقة لكل وحدة المساحة على كائن أو مادة. ويمكن أيضا تعريفها بأنها القوة التي تطبقها الجسيمات المتصادمة على بعضها البعض، وغالبا ما يتم قياسها باستخدام باسكال. في حالة اصطدام الجسيمات، يتم استخدام معادلة الغاز والنظرية الحركية للغازات لحساب الضغط.
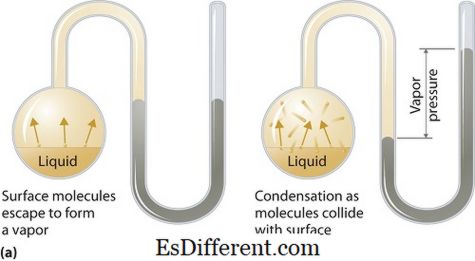
ما هو ضغط البخار؟
يمكن أن ينطبق ضغط البخار على مراحل سائلة أو صلبة. هو الضغط الذي يمارسه البخار في توازنه الديناميكي الحراري على السائل أو الحالة الصلبة عند درجة حرارة معينة في نظام مغلق عندما يكون كل من البخار والسائل (الصلبة) في اتصال. وينشأ هذا الضغط نتيجة التبخر، الذي يتم تمكينه بزيادة الحرارة على المادة الصلبة أو السائلة. وبالتالي يتم استخدام درجة الحرارة كمقياس التبخير ويتناسب طرديا مع ضغط البخار. وهذا يعني، وارتفاع درجة الحرارة هو ارتفاع ضغط البخار.
أثناء التبخير، تفلت جزيئات الهواء نتيجة الطاقة الحركية العليا للهواء في نظام مغلق. ثم عندما يكون في التوازن، وينشأ ضغط البخار بين البخار وشكله المكثف من السائل (الصلبة). في الحلول حيث القوى بين الجزيئات أضعف، وضغط البخار تميل إلى أن تكون أكثر، وعلى العكس من ذلك، في الحلول حيث القوى بين الجزيئات هي أقوى، وضغط البخار هو أقل.
يمكن أن يحدث ضغط البخار أيضا في الخلطات المثالية كما هو موضح في قانون رولت. ويذكر أن ضغط البخار الجزئي لعنصر معين في خليط سائل أو صلب يساوي ضغط البخار لهذا المكون مضروبا في جزءه من الخليط في هذا الخليط عند درجة حرارة معينة. سيوضح المثال أدناه ذلك.
مثال 1.
نظرا لخليط مثالي من 0. 5 مول. الإيثانول و 1. 5 مول. الميثانول مع ضغط بخار 30KPa و 52KPa، على التوالي، وتحديد ضغط بخار جزئي من كل مكون.
الحل:
العدد الكلي للشامات هو 1. 5mol + 0. 5mol = 2. 0mol. وفقا لقانون رولت، فإن ضغط البخار الجزئي يساوي ضغط البخار مضروبا في الجزء المولي من هذا المكون بعينه.في هذه الحالة، P الميثانول = 1. 5/2 * 52 = 39KPa و P الإيثانول = 0. 5/2 * 30 = 7. 5KPa.
عندما يكون لديك ضغط البخار الجزئي للمكونات في الخليط، يمكنك الحصول على إجمالي ضغط البخار عن طريق إضافتها معا. في هذا الصدد، 7. 5 + 39 يعطي 46. 5KPa إجمالي ضغط بخار خليط من الإيثانول والميثانول الحلول.
العوامل التي تؤثر على ضغط البخار
هوية الجزيئات
كما سبق ذكره أعلاه، فإن أنواع القوى الجزيئية تحدد مقدار ضغط البخار الذي يجب القيام به. إذا كانت القوى أقوى، ثم أقل ضغط بخار يبرز، وإذا أضعف، ثم المزيد من ضغط البخار ينشأ. ولذلك، فإن تكوين السائل أو الصلبة تؤثر على ضغط البخار.
درجة الحرارة
ارتفاع درجة الحرارة يؤدي إلى ارتفاع ضغط البخار لأنه ينشط المزيد من الطاقة الحركية لكسر القوى الجزيئية بحيث يمكن للجزيئات الهروب من سطح السائل بسرعة. عندما يساوي ضغط البخار (ضغط البخار المشبع) الضغط الخارجي (الضغط الجوي)، سيبدأ السائل في الغليان. وسوف يؤدي انخفاض درجة الحرارة مع انخفاض ضغط البخار وسوف يستغرق وقتا طويلا ليغلي السائل.

قانون دالتون للضغوط الجزئية
ما هو الضغط الجزئي؟
فكرة الضغط الجزئي اقترحت لأول مرة من قبل العالم الشهير جون دالتون. وقد أنجبت قانون الضغط الجزئي الذي ينص على أن إجمالي الضغط الذي يمارسه خليط مثالي من الغازات يساوي مجموع الضغوط الجزئية للغازات الفردية. قل حاوية معينة مليئة غازات الهيدروجين والنيتروجين والأكسجين، والضغط الكلي، P المجموع، سوف تكون مساوية لمجموع الأكسجين والنيتروجين والهيدروجين. يتم حساب الضغط الجزئي لأي غاز في هذا الخليط بضرب إجمالي الضغط بواسطة الجزء المولي من الغاز الفردي.
باختصار، الضغط الجزئي هو الضغط الذي يمارسه غاز معين في الخليط كما لو كان يعمل وحده في النظام. وهكذا يمكنك تجاهل الغازات الأخرى عند تحديد الضغط الجزئي من الغاز الفردية. يمكن التحقق من هذه النظرية عن طريق الحقن، على سبيل المثال، 0. 6atm من O 2 في حاوية 10. 0 L عند 230K ثم الحقن 0. 4atm N 2 من نفس الحجم في نفس درجة الحرارة، ومن ثم الجمع في نهاية المطاف الغازات لقياس الضغط الكلي. وسوف يكون مجموع الغازات اثنين. هذا يفسر بوضوح الضغط الجزئي من الغاز الفردية في خليط من الغازات غير رد الفعل.
حساب الضغط الجزئي
لحساب الضغط الجزئي هو نسيم مطلق لأن قانون دالتون [1] يوفر أحكاما لذلك. وسوف تعتمد على المعلومات النموذجية المقدمة. على سبيل المثال، إذا تم إعطاء الضغط الكلي لمزيج من الغاز A و B وكذلك ضغط الغاز A، يمكن حساب الضغط الجزئي B باستخدام P توتال = P A + P B . والباقي هو التلاعب جبري. ولكن في حالة حيث تم إعطاء فقط الضغط الكلي للخليط، يمكنك استخدام جزء المولي من الغاز B لتحديد الضغط الجزئي.يمكن العثور على جزء المولي، الذي يرمز إليه X، عن طريق تقسيم شامات الغاز B عن طريق الشامات الكلية لخليط الغاز. ثم للعثور على الضغط الجزئي، سوف تتضاعف جزء المولي، X، من خلال الضغط الكلي. يوضح المثال أدناه ذلك.
مثال 2.
مزيج من النيتروجين والأكسجين، مع 2. 5 مولس و 1. 85 مول، على التوالي، يتم حقنه في حاوية 20. 0L مع الضغط الكلي من 4atm. حساب الضغط الجزئي الذي تمارسه غاز الأكسجين.
الحل:
العدد الكلي للشامات في الخليط هو 2. 5 + 1. 85 = 4. 35 مول. وبالتالي فإن الجزء المولي من الأكسجين، X س ، سيكون 1. 85 مول / 4. 35 مولس = 0. 425 مولس. الضغط الجزئي للأكسجين سيكون 0. 425 * 4atm = 1. 7atm. ويمكن حساب الضغط الجزئي للغاز المتبقي وفقا لنفس النهج أو يمكن حسابه باستخدام غاز الأكسجين والضغط الكلي كما هو مبين في قانون دالتون من الضغوط الجزئية أن إجمالي الضغط من الغازات غير رد الفعل يساوي مجموع الضغوط الجزئية.
الفرق بين بخار والضغط الجزئي
من التفسيرات أعلاه، فمن الواضح أن ضغط البخار والضغط الجزئي هما ضغوط متميزة. وينطبق ضغط البخار على الأطوار السائلة والصلبة بينما ينطبق الضغط الجزئي على الطور الغازي. يتم ضغط البخار في مرحلة الانتقال بعد إضافة حرارة كافية إلى المحلول مما يؤدي إلى جزيئاته للهروب في نظام مغلق.
والفرق الرئيسي بين الضغط الجزئي وضغط البخار هو أن الضغط الجزئي هو الضغط الذي يمارسه غاز فردي في خليط كما لو كان وحده في ذلك النظام، في حين أن ضغط البخار يشير إلى الضغط الذي يمارسه البخار في التوازن الحراري مع الحالة المكثفة من السائل أو الصلبة. ويقدم الجدول أدناه مقارنة موجزة لهذه الضغوط.
| الضغط البخاري | الضغط الجزئي |
| يتم ذلك بواسطة بخار سائل أو صلب على مرحلته المكثفة في التوازن | ويتم ذلك بواسطة غازات فردية في خليط غاز غير تفاعلي |
| القانون | تم شرحه بشكل جيد من قبل قانون دالتون |
| ينطبق في المراحل الصلبة والسائلة | ينطبق في مراحل الغاز فقط |
| مستقلة عن مساحة السطح أو حجم النظام | محسوبة باستخدام الغازات في نفس حجم |
| يحسب باستخدام جزء الخلد من المذاب | يحسب باستخدام جزء الخلد من الغاز |
التفاف!
ضغط البخار والضغط الجزئي هما المصطلحان العلميان المهمان المستخدمان في تحديد تأثيرات القوى التي يطبقها البخار والغازات، على التوالي، في نظام مغلق معين عند درجات حرارة معينة. والفرق الرئيسي بينهما هو مجال التطبيق مع ضغط البخار المطبق على مراحل سائلة أو صلبة، في حين يتم تطبيق الضغط الجزئي على غاز فردي في خليط من الغازات المثالية في مجلد معين.
يتم حساب الضغط الجزئي بسهولة باتباع قانون دالتون للضغط الجزئي، في حين يتم حساب ضغط البخار من خلال تطبيق قانون رولت.في أي خليط معين، يمارس كل مكون غاز ضغطه الخاص، وهو ما يسمى الضغط الجزئي المستقل عن الغازات الأخرى. وعند مضاعفة الشامات من أي مكون مع درجة الحرارة المتبقية ثابتة، سوف تكون زيادة الضغط الجزئي. وفقا لعلاقة كلاوسيوس كلابيرون [2]، يزيد ضغط البخار مع زيادة درجة الحرارة.
مع المعلومات المذكورة أعلاه، يجب أن تكون قادرا على التمييز بين ضغط البخار والضغط الجزئي. يجب عليك أيضا أن تكون قادرة على حسابها باستخدام الكسور المولي والضرب من خلال الضغط الكلي. لقد قدمنا لك أمثلة نموذجية لتوضيح تطبيق هذه الضغوط.




