الفرق بين ذرات ميكروثوميك و دياتوميك | موناتوميك فس دياتوميك
الفرق بين ذرات مذرية و ذريحة في المقام الأول فيما يتعلق الذرات الموجودة في الأنواع. وكما توحي الأسماء، فإن كلا المصطلحين يقفان إلى دول مختلفة للجمعيات الذرية حيث تعني كلمة "أحادية" "واحدة" و "دي" تعني "اثنين". لذلك، ببساطة، موناتوميك يعني واحد '
ذرة واحدة ' وذرات دياتوميك ' ذرات اثنين. ومع ذلك، يمكن أن يكون هناك العديد من الاختلافات المختلفة لهذا التعريف الأساسي.
ما هو موناتوميك؟عندما
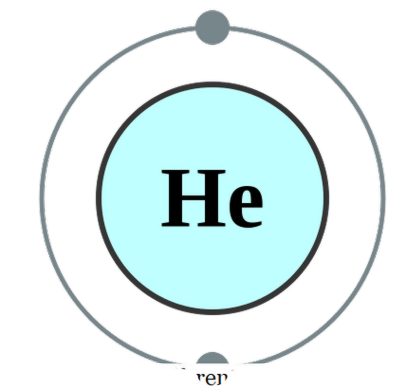
ذرة واحدة موجودة على (نادرا ما تكون الحالة)، ونحن نسميها ذرة واحدة. وهذا يعني أن العناصر هي في شكلها النقي الخالص. والمثال العملي الوحيد الذي قد يندرج تحت هذه الفئة هو الغازات النبيلة التي توجد كذرات من تلقاء نفسها، حيث أن غلافها الخارجي ينجز مع ثماني إلكترونات. وبالتالي، فإنها لا تبدو لقبول أو التبرع المزيد من الإلكترونات من أجل أن تكون أكثر استقرارا. لذلك، الغازات النبيلة مستقرة في شكل أحادي. بعض الأمثلة هي؛ هو - الهيليوم، ن - النيون، أر - الأرجون، ز - زينون، كر - كريبتون، رن - الرادون.
ما هو دياتوميك؟
عندما
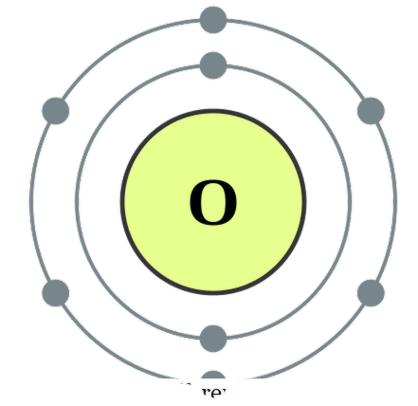
اثنين من الذرات هي في ارتباط مع بعضها البعض، ونحن نسميها دياتوميك. هذه الذرات يمكن أن تكون من نفس النوع أو مختلفة. عندما نكون ذراتين مماثلتين نسميها دياتومات نووية نووية وإذا كانت مصنوعة من أنواع مختلفة نسميها دياتومات نووية نووية نووية . ومن الأمثلة على بعض الدياتومات الحلقية هي O2، N2، H2، وما إلى ذلك في حين أن كو، نو، هكل، وما يمكن أن تعطى كأمثلة ل دياتومز نووية النواة. الأكسجين
ويمكن اعتبار الدياتومات كمركبات لأنها تشكل هذه الجمعيات من أجل تحقيق المزيد من الاستقرار من خلال تقاسم الإلكترونات مع بعضها البعض بحيث كل من الذرات تحقيق التكوين الإلكتروني الغاز النبيل. يمكن أن تربط السندات التساهمية من خلال تداخل المدارات الذرية أو أنها يمكن أن تشكل روابط الأيونية فيما بينها والتي هي قوة جذب بين الأنواع ذات الشحنة الإيجابية وأنواع سالبة الشحنة. وتشمل الأمثلة على الروابط التساهمية بين الدياتومات كو، نو، وما إلى ذلك، ويمكن اعتبار حمض الهيدروكلوريك كأنواع ذات طابع جذب أيوني. ومع ذلك، وبما أن قوة الجذب بين H + و Cl- ليست قوية جدا، فإنه ليس مثالا جيدا جدا للسندات الأيونية التي هي موضوع آخر محدد.
ما هو الفرق بين موناتوميك و دياتوميك؟
• الأنواع الموناتومية لها ذرة واحدة في حين أن الأنواع ذرية الذرة ذرات اثنين.
• الأنواع الموناتومومية ليست مستقرة بشكل عام، ولكن الأنواع ذرية الذرة مستقرة بشكل عام.
• الغازات النبيلة هي أحادية الذرات فقط ولا توجد في شكل ذريحي.
• توجد روابط كيميائية بين الأنواع ذرية الذرة في حين لا توجد روابط في الأنواع أحادية الذرة.
إيماجيس كورتيسي:
هيليوم إليكترون كونفيغوراتيون بي بومبا (سيسي بي-سا 2. 0 أوك)
- تكوين الإلكترون الأكسجين بواسطة ديبيب (سيسي بي-سا 3. 0)



