الفرق بين نترات الأمونيوم واليوريا
نترات الأمونيوم مقابل اليوريا
المركبات التي تحتوي على النيتروجين تستخدم عادة كأسمدة لأن النيتروجين هو واحد من العناصر الأساسية للغاية نمو النبات والتنمية. نترات الأمونيوم واليوريا هي مثل النيتروجين التي تحتوي على المواد الصلبة.
نترات الأمونيوم
نترات الأمونيوم لديه الصيغة الكيميائية من نه 4 لا 3 . هذا هو نترات الأمونيا، ولها البنية التالية.

في درجة حرارة الغرفة والضغط القياسية نترات الأمونيوم موجودة كرائحة بلورية بيضاء عديم الرائحة. هذا هو ملح الحمضية مع درجة الحموضة من حوالي 5. 4. الكتلة المولية هو 80. 052 ز / مول. نقطة انصهار نترات الأمونيوم حوالي 170 درجة مئوية، وتحلل عندما تسخن إلى حوالي 210 س C. وتستخدم نترات الأمونيوم في المقام الأول للأغراض الزراعية. انها غنية في النيتروجين، لذلك يتم استخدامه كسماد، لتوريد النيتروجين إلى النباتات. منذ اتصالها المباشر مع المواد الكيميائية ليست خطرة وسمية منه هو أقل، فمن المفيد لاستخدامها كأسمدة. وعلاوة على ذلك، والتدفئة أو الاشتعال يسبب نترات الأمونيوم لتنفجر. ولذلك، فإنه يستخدم كعامل مؤكسد في المتفجرات. وبسبب هذه الطبيعة المتفجرة، عند تخزين نترات الأمونيوم يجب أن نكون حذرين للغاية. نترات الأمونيوم مستقرة، ولكن عندما يكون في خطر الدولة المنصهر للانفجار هو أعلى. وتزداد المخاطرة إذا كان الأمر يتعلق بالاتصال بالمواد القابلة للتأكسد مثل الزيت أو الديزل أو الورق أو الخرقة أو القش. إنتاج نترات الأمونيوم هو تفاعل كيميائي بسيط. عندما يتم تفاعل حمض النتريك مع السائل الأمونيا، ويتم إنتاج نترات الأمونيوم في شكل حل. يتم استخدام حمض النتريك والغاز الأمونيا المركز للإنتاج. وبما أن هذا رد فعل شديد الطاردة للحرارة والعنف، فإنه من الصعب إنتاجه على نطاق واسع. كونه ملح، نترات الأمونيوم هو قابل للذوبان للغاية في الماء. لذلك، عندما يتم استخدامه كسماد يمكن غسلها وتتراكم في المسطحات المائية. هذا يمكن أن يكون حالة قاتلة للحياة المائية.
اليوريا
اليوريا لديها الصيغة الجزيئية ل كو (نه 2 ) 2 والهيكل التالي.
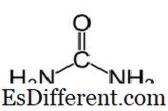
ومن الكرباميد مع مجموعة وظيفية C = O. اثنين من نه 2 مجموعات مستعبدين لكربون الكربونيل من الجانبين. ينتج اليوريا طبيعيا في الثدييات في عملية التمثيل الغذائي للنيتروجين. هذا هو المعروف باسم دورة اليوريا، وأكسدة الأمونيا أو الأحماض الأمينية تنتج اليوريا داخل أجسادنا. يفرز معظم اليوريا من خلال الكلى مع البول في حين تفرز بعض مع العرق. ارتفاع قابلية ذوبان الماء في اليوريا مفيد عند إفرازه من الجسم. اليوريا هو عديم اللون، عديم الرائحة الصلبة، وأنه غير سامة. بخلاف كونه منتج الأيضية، واستخدامه الرئيسي هو إنتاج الأسمدة.اليوريا هي واحدة من الأسمدة النيتروجين الإفراج الأكثر شيوعا، ولها محتوى النيتروجين عالية مقارنة مع الأسمدة النيتروجينية الصلبة الأخرى. في التربة، يتم تحويل اليوريا إلى الأمونيا وثاني أكسيد الكربون. ويمكن تحويل هذه الأمونيا إلى النتريت بواسطة بكتيريا التربة. وعلاوة على ذلك، يتم استخدام اليوريا لإنتاج المتفجرات مثل نترات اليوريا. يتم استخدامه أيضا كمواد خام لإنتاج المواد الكيميائية مثل البلاستيك والمواد اللاصقة.
|
ما هو الفرق بين نترات الأمونيوم واليوريا ؟ • الصيغة الجزيئية لنترات الأمونيوم هي نه 4 لا 3. الصيغة الجزيئية لليوريا هي كو (نه 2 ) 2. • نترات الأمونيوم هو ملح، في حين أن اليوريا ليست كذلك. وهو كرباميد (جزيء عضوي). عندما يذوب في نترات الأمونيوم المياه تنتج محلول حامضي. في المقابل اليوريا الحلول ليست حمضية ولا قلوية. |




