الفرق بين 1S و 2S المداري | 1s فس 2s أوربيتال
الفرق الرئيسي - 1s مقابل 2s المدارية
الذرة هي أصغر وحدة من المادة. وبعبارة أخرى، كل شيء مصنوع من الذرات. وتتكون الذرة من جزيئات دون ذرية، وبصفة رئيسية البروتونات والإلكترونات والنيوترونات. البروتونات والإلكترونات تجعل النواة، التي تقع في وسط الذرة. ولكن يتم وضع الإلكترونات في المدارات (أو مستويات الطاقة) التي تقع خارج نواة الذرة. ومن المهم أيضا أن نلاحظ أن المدارات هي مفاهيم افتراضية التي تستخدم لشرح الموقع الأكثر احتمالا للذرة. هناك مدارات مختلفة تحيط النواة. وهناك أيضا مدارات فرعية مثل s و p و d و f وما إلى ذلك. أما المدار الفرعي الفرعي فهو كروي الشكل عندما ينظر إليه على أنه هيكل ثلاثي الأبعاد. المدار s لديه أعلى احتمال للعثور على الإلكترون حول النواة. ويتم ترقيم المدار الفرعي مرة أخرى على أنه 1s، 2s، 3s، إلخ. وفقا لمستويات الطاقة. والفرق الرئيسي بين المدارتين 1 و 2 المداري هو طاقة كل مداري. 1s المدارية لديها طاقة أقل من المدار 2S.
المحتويات
1. نظرة عامة والفرق الرئيسي
2. ما هو 1S المداري
3. ما هو 2S المدارية
4. جنبا إلى جنب مقارنة - 1S مقابل 2S المداري
5. ملخص
ما هو 1S المداري؟
1s المداري هو المداري الأقرب إلى النواة. ولديها أدنى طاقة بين المدارات الأخرى. بل هو أيضا أصغر شكل كروي. ولذلك، فإن نصف قطر المدار صغير. يمكن أن يكون هناك فقط 2 الإلكترونات في المدار s. يمكن كتابة تكوين الإلكترون على أنه 1s 1 ، إذا كان هناك إلكترون واحد فقط في المدار s. ولكن إذا كان هناك زوج من الإلكترونات، فإنه يمكن أن تكون مكتوبة كما 1s 2 . ثم اثنين من الإلكترونات في الخطوة المدارية إلى الاتجاهات المعاكسة بسبب التنافر الذي يحدث بسبب نفس الرسوم الكهربائية من الإلكترونات اثنين. عندما يكون هناك إلكترون أونبايرد، ويسمى باراماجنيتيك. وذلك لأنه يمكن جذبها بواسطة المغناطيس. ولكن إذا تم ملء المداري وزوج من الإلكترونات موجودة، لا يمكن جذب الإلكترونات بواسطة المغناطيس. هذا، نوكأ، معروف، برغم، دياماغنيتيك.
ما هو 2S المداري؟
المدار 2S أكبر من 1S المدارية. وبالتالي، فإن نصف قطرها أكبر من نصف قطر المدار 1s. هو المدار خزانة المقبل إلى النواة بعد 1S المدارية. طاقته أعلى من 1s المداري ولكن أقل من المدارات الأخرى في الذرة. 2S المداري أيضا يمكن ملؤها فقط مع واحد أو اثنين من الإلكترونات. ولكن 2S المداري مليئة الإلكترونات فقط بعد الانتهاء من 1S المدارية.وهذا ما يسمى مبدأ أوفاو، الذي يشير إلى ترتيب ملء الإلكترون في المدارات الفرعية.
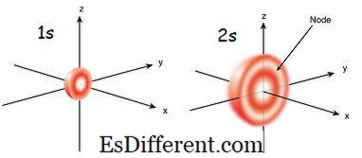
الشكل 01: 1s و 2s المداري
ما هو الفرق بين 1s و 2s المدارية؟
- ديف المادة قبل منتصف الجدول ->
1s مقابل 2S المداري |
|
| 1S المداري هو أقرب المدار إلى النواة. | 2S المداري هو ثاني أقرب المدار إلى النواة. |
| مستوى الطاقة | |
| طاقة 1s المداري أعلى من 2S المدارية. | 2S لديها طاقة أقل نسبيا. |
| نصف قطر المداري | |
| نصف قطر المدار 1s أصغر. | نصف قطر المدار 2s كبير نسبيا. |
| حجم المداري | |
| 1s المداري لديه أصغر شكل كروي. | 2s المداري أكبر من المدار 1S. |
| تعبئة الإلكترون | |
| يتم ملء الإلكترونات أولا في المدار 1s. | يتم تعبئة المدار 2S فقط بعد اكتمال الإلكترونات في المدار 1s. |
ملخص - 1s فس 2s أوربيتال
الذرة هي بنية ثلاثية الأبعاد تحتوي على نواة في الوسط تحيط بها مدارات ذات شكل مختلف لمستويات مختلفة من الطاقة. وتنقسم هذه المدارات مرة أخرى إلى مدارات فرعية وفقا لفروق طفيفة في الطاقة. الإلكترونات، التي هي جسيمات دون ذرية كبيرة من الذرة تقع في هذه المستويات الطاقة. 1s و 2s المدارات الفرعية هي أقرب إلى النواة. والفرق الرئيسي بين المدارات 1s و 2s هو الفرق في مستوى طاقتها، وهو، 2S المداري هو مستوى طاقة أعلى من 1S المدارية.
المرجع:
1. Libretexts. "المدارات الذرية. "الكيمياء ليبرتكستس. ويبريكس، 03 نوفمبر 2015. ويب. 26 مايو 2017..
2. الذرات، الإلكترونات والمدارات. N. p. ، n. د. على شبكة الإنترنت. 26 مايو 2017..
إيماج كورتيسي:
1. "S المدارات" (اقتصاص) من قبل سك-12 فونداتيون - ملف: مدرسة ثانوية الكيمياء. بدف، صفحة 265 (سيسي بي-سا 3. 0) عبر ويكومديا كومونس


